题目内容
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法.该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠.各步骤反应的化学方程式如下:
①2NaCl+H2SO4
Na2SO4+2HCl↑
②Na2SO4+2C
Na2S+2CO2↑
③Na2S+CaCO3
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量是
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度.
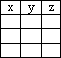
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为y g,电子转移数为z mol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少.
①2NaCl+H2SO4
| 500℃ |
②Na2SO4+2C
| 1000℃ |
③Na2S+CaCO3
| 1000℃ |
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量是
0.883
0.883
kg.(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是
Na2SO4+4C=Na2S+4CO↑
Na2SO4+4C=Na2S+4CO↑
.若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的质量是0.883
0.883
kg,此时消耗碳单质的量是原步骤②反应用碳量的2
2
倍.(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度.
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为y g,电子转移数为z mol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少.
| x | y | z |
分析:(1)依据化学方程式的定量关系,分析氯化钠和碳酸钠的定量关系计算得到;
(2)过量碳和二氧化碳反应生成一氧化碳;依据化学方程式中物质的定量关系分别计算得到所求各量;
(3)样品和稀硝酸反应硫元素变化为硫单质质量计算物质的量,结合硫元素守恒计算CaS的质量,样品与盐酸反应生成的二氧化碳物质的量计算样品中CaCO3物质的量得到质量,计算得到碳酸钠质量计算质量分数;
(4)依据化学方程式分析得到恰好反应时氯化钠和碳物质的量之比x=1,讨论氯化钠过量和碳过量时的化学方程式计算讨论得到所计算的量.
(2)过量碳和二氧化碳反应生成一氧化碳;依据化学方程式中物质的定量关系分别计算得到所求各量;
(3)样品和稀硝酸反应硫元素变化为硫单质质量计算物质的量,结合硫元素守恒计算CaS的质量,样品与盐酸反应生成的二氧化碳物质的量计算样品中CaCO3物质的量得到质量,计算得到碳酸钠质量计算质量分数;
(4)依据化学方程式分析得到恰好反应时氯化钠和碳物质的量之比x=1,讨论氯化钠过量和碳过量时的化学方程式计算讨论得到所计算的量.
解答:解:(1)反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量可以依据化学方程式分析氯化钠和碳酸钠的定量关系,设生成碳酸钠需要氯化钠质量为X;
①2NaCl+H2SO4
Na2SO4+2HCl↑
②Na2SO4+2C
Na2S+2CO2↑
③Na2S+CaCO3
Na2CO3+CaS
得到 2NaCl~Na2CO3
2×58.5 1×106
X 1Kg×80%
X=0.883Kg;
故答案为:0.883;
(2)步骤②碳单质过量时也同样可以反应获得Na2S,过量碳和二氧化碳反应生成一氧化碳,此时所发生的反应的化学方程式:Na2SO4+4C=Na2S+4CO↑;
若其它条件不变,步骤②按此反应进行,分析化学方程式得到计算定量关系仍是 2NaCl~Na2CO3 ,所以每获得1kg纯度为80%的纯碱需要氯化钠的质量是0.883Kg;
根据化学方程式得到2C~Na2CO3;按照Na2SO4+4C=Na2S+4CO↑反应得到 4C~Na2CO3;所以此时消耗碳单质的量是原步骤②反应用碳量二倍;
故答案为:Na2SO4+4C=Na2S+4CO↑;0.883;2;
(3)纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g物质的量=
=0.005mol,依据硫元素守恒,CaS质量=0.005mol×72g/mol=0.36g;另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L物质的量
=0.0965mol,气体为二氧化碳和硫化氢,硫化氢物质的量为0.005mol,二氧化碳物质的量=0.0965mol-0.005mol=0.0915mol,元素守恒得到:
设CaCO3 质量x,Na2CO3质量为y;得到x+y+0.005=0.0965,100x+106y=10-0.36,计算得到x=0.0115mol,y=0.0817mol,
碳酸钠的纯度=
×100%=86.6%;
答:碳酸钠的纯度为86.6%;
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为y g,电子转移数为z mol,过程反应分析得到:
①2NaCl+H2SO4
Na2SO4+2HCl↑
②Na2SO4+2C
Na2S+2CO2↑
③Na2S+CaCO3
Na2CO3+CaS
依据化学方程式得到2NaCl~2C~2CO2~8e-;
x=1
当x>1,氯化钠过量,按照碳计算
n(C)=
,2C~Na2CO3生成的碳酸钠物质的量
mol,质量y=
mol×106g/mol=
;z=
mol;
当x≤1时,按照氯化钠计算,2NaCl~Na2CO3+生成碳酸钠物质的量为
mol,y=
mol×106g/mol=53a,z=4a;
故答案为:
①2NaCl+H2SO4
| 500℃ |
②Na2SO4+2C
| 1000℃ |
③Na2S+CaCO3
| 1000℃ |
得到 2NaCl~Na2CO3
2×58.5 1×106
X 1Kg×80%
X=0.883Kg;
故答案为:0.883;
(2)步骤②碳单质过量时也同样可以反应获得Na2S,过量碳和二氧化碳反应生成一氧化碳,此时所发生的反应的化学方程式:Na2SO4+4C=Na2S+4CO↑;
若其它条件不变,步骤②按此反应进行,分析化学方程式得到计算定量关系仍是 2NaCl~Na2CO3 ,所以每获得1kg纯度为80%的纯碱需要氯化钠的质量是0.883Kg;
根据化学方程式得到2C~Na2CO3;按照Na2SO4+4C=Na2S+4CO↑反应得到 4C~Na2CO3;所以此时消耗碳单质的量是原步骤②反应用碳量二倍;
故答案为:Na2SO4+4C=Na2S+4CO↑;0.883;2;
(3)纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g物质的量=
| 0.16g |
| 32g/mol |
| 2.162L |
| 22.4L/mol |
设CaCO3 质量x,Na2CO3质量为y;得到x+y+0.005=0.0965,100x+106y=10-0.36,计算得到x=0.0115mol,y=0.0817mol,
碳酸钠的纯度=
| 0.0817mol×106g/mol |
| 10g |
答:碳酸钠的纯度为86.6%;
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为y g,电子转移数为z mol,过程反应分析得到:
①2NaCl+H2SO4
| 500℃ |
②Na2SO4+2C
| 1000℃ |
③Na2S+CaCO3
| 1000℃ |
依据化学方程式得到2NaCl~2C~2CO2~8e-;
x=1
当x>1,氯化钠过量,按照碳计算
n(C)=
| amol |
| x |
| a |
| 2x |
| a |
| 2x |
| 53a |
| x |
| 4a |
| x |
当x≤1时,按照氯化钠计算,2NaCl~Na2CO3+生成碳酸钠物质的量为
| a |
| 2 |
| a |
| 2 |
故答案为:
| x | y | z |
| x>1 | 53a/x | 4a/x |
| x≤1 | 53a | 4a |
点评:本题考查了物质性质的实验探究方法和实验分析计算,方案设计和过程分析是解题关键,题目难度中等.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
 Na2SO4+2HCl↑
Na2SO4+2HCl↑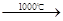 Na2S+2CO2↑
Na2S+2CO2↑

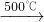 Na2SO4+2HCl↑
Na2SO4+2HCl↑ Na2S+2CO2↑
Na2S+2CO2↑