题目内容
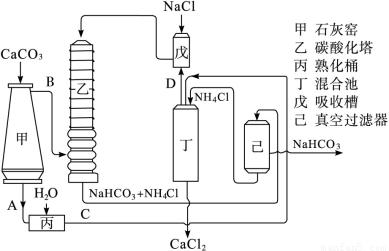
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4 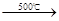 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C
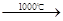 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3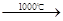 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________kg,此时消耗碳单质的量是原步骤②反应用碳量的____倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
|
x |
y |
z |
|
|
|
|
|
|
|
|
|
|
|
|
(1)0.883(2分)
(2)Na2SO4+4C  Na2S
+ 4CO↑, 0.883 , 2 (1分+1分+分)
Na2S
+ 4CO↑, 0.883 , 2 (1分+1分+分)
(3)86.6% (5分)
(4)(每空1分)
|
x |
y |
z |
|
x>1 |
53a/x |
4a/x |
|
x≤1 |
53a |
4a |
|
|
|
|
【解析】
试题分析:(1)根据Na元素守恒可得对应关系:2NaCl ~ Na2CO3,m(NaCl)=1kg×80%×117÷106=0.883kg。
(2)过量的C生成CO。配平可得化学方程式;Na元素守恒,需要的NaCl的质量不变,仍然是0.883kg;对比化学方程式,可知C的用量为原来的2倍。
(3)CaS的物质的量等于S,m(CaS)=0.16g÷32g/mol×72g/mol=0.36g,CaCO3、Na2CO3的质量和=10g-0.36g=9.64g,CaCO3、Na2CO3的物质的量和等于CO2的物质的量,m(CaCO3)=2.162L÷22.4L/mol — 0.16g÷32g/mol =0.092mol,则m(Na2CO3)÷106g/mol +【9.64g—m(Na2CO3)】÷110g/mol=0.092mol,得m(Na2CO3)=8.86g,进而得Na2CO3的纯度为86.6%。
(4)x≤1,C足量,根据2NaCl ~ Na2CO3,m(Na2CO3)= a÷2×106=53a,只有反应②为氧化还原反应,S元素由+4价变为0价,所以转移电子物质的量为4a;x>1时,C不足,应根据C的物质的量进行计算,n(C)= a/xmol,m(Na2CO3)= ax÷2×106=53a/x,转移电子物质的量为4a/x。
考点:本题考查化学计算、化学方程式的书写。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案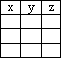
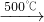 Na2SO4+2HCl↑
Na2SO4+2HCl↑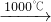 Na2S+2CO2↑
Na2S+2CO2↑