网址:http://m.1010jiajiao.com/timu3_id_431099[举报]
A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。 查看习题详情和答案>>
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。
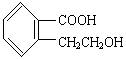 它可通过不同的化学反应分别制得下列物质:
它可通过不同的化学反应分别制得下列物质:
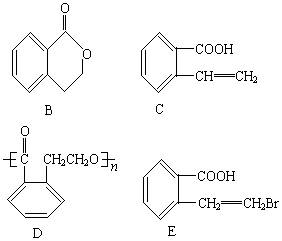
制取B、C、D、E四种物质对应的有机反应类型分别为B:________C:________D:________E:________。
(2)不久前,欧盟对我国出口的酱油进行检测发现,部分酱油中3-氮-1,2-丙二醇(CH2Cl-CHOH-CH2OH)含量最高达10mg/L,超过欧盟规定的该项指标的一千倍。①3-氯-1,2-丙二醇和1,3-二氯-2-二氯-2-丙醇统称为“氯丙醇”,都是致癌物。1,3-二氯-2-丙醇的结构简式是( )
A.CH2OH—CHCl—CH2OH
B.CH2CL—CHOH—CH2Cl
C.CH2OH—CHOH—CH2Cl
D.CH2Cl—CHOH—CH(OH)Cl
②我国就此作了调查并对酱油进行技术处理,使酱油中不含氯丙醇或不超标。技术处理过程中应用的反应是( )
A.加成反应
B.氧化反应
C.消去反应
D.取代反应
(3)A是日常生活中常见的一种有机物,A在一定条件下有如下的转化关系:

B是无氧化合物,且是其同系物中相对分子质量最小的物质,B能使紫色石蕊试液变红,则A的结构简式为________,A、B、C、D四种物质中易溶于水的物质是________(填写序号)。
(4)化学式为C4H6O5的有机物A有如下性质:
Ⅰ.1 mol A+2 mol NaOH→正盐
![]()
![]()
Ⅳ.A的分子内脱水产物(不是环状化合物)可使溴水褪色试回答:
①根据以上信息,对A的结构的正确判断是(选填序号)________。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有醇烃基 d.有RCOOR′结构
②若A分子中不含甲基,其结构简式为________或________。
③写出A分子内脱水产物与溴水反应的化学方程式(只写一个)
________________________________
④写出A的一个同类别的同分异构体(含甲基)的结构简式
________________________________
查看习题详情和答案>>
(1)有机物A的结构简式为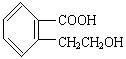 它可通过不同的化学反应分别制得下列物质:
它可通过不同的化学反应分别制得下列物质:
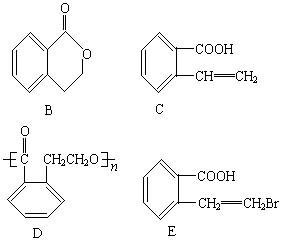
制取B、C、D、E四种物质对应的有机反应类型分别为B:________C:________D:________E:________。
(2)不久前,欧盟对我国出口的酱油进行检测发现,部分酱油中3-氮-1,2-丙二醇(CH2Cl-CHOH-CH2OH)含量最高达10mg/L,超过欧盟规定的该项指标的一千倍。①3-氯-1,2-丙二醇和1,3-二氯-2-二氯-2-丙醇统称为“氯丙醇”,都是致癌物。1,3-二氯-2-丙醇的结构简式是( )
A.CH2OH—CHCl—CH2OH
B.CH2CL—CHOH—CH2Cl
C.CH2OH—CHOH—CH2Cl
D.CH2Cl—CHOH—CH(OH)Cl
②我国就此作了调查并对酱油进行技术处理,使酱油中不含氯丙醇或不超标。技术处理过程中应用的反应是( )
A.加成反应
B.氧化反应
C.消去反应
D.取代反应
(3)A是日常生活中常见的一种有机物,A在一定条件下有如下的转化关系:

B是无氧化合物,且是其同系物中相对分子质量最小的物质,B能使紫色石蕊试液变红,则A的结构简式为________,A、B、C、D四种物质中易溶于水的物质是________(填写序号)。
(4)化学式为C4H6O5的有机物A有如下性质:
Ⅰ.1 mol A+2 mol NaOH→正盐
![]()
![]()
Ⅳ.A的分子内脱水产物(不是环状化合物)可使溴水褪色试回答:
①根据以上信息,对A的结构的正确判断是(选填序号)________。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有醇烃基 d.有RCOOR′结构
②若A分子中不含甲基,其结构简式为________或________。
③写出A分子内脱水产物与溴水反应的化学方程式(只写一个)
________________________________
④写出A的一个同类别的同分异构体(含甲基)的结构简式
________________________________
查看习题详情和答案>>
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),

查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1)??????? 。
(2)D装置的作用是??????? 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是?????? 。
A.亚硝酸盐是还原剂????????????? ????????????? ????????????? ? B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+????????????? ????????????? ????????????? ? D.亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是?????????
A .测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法??
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式??????????????????????????????????????????? 。
查看习题详情和答案>>