题目内容
A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。
(1) 四 (1分) Ⅷ (1分) 3d64s2 (2分) 2Fe3++Cu =" 2" Fe2+ + Cu2+ (2分)
(2)离子 (2分) NH3与H2O分子间可以形成氢键 (2分)
(3) N (1分) b c (2分)
(4)2Al(s) +3FeO(s) = Al2O3(s) + 3Fe (s) △H =" -3462" kJ/mol (3分)
(2)离子 (2分) NH3与H2O分子间可以形成氢键 (2分)
(3) N (1分) b c (2分)
(4)2Al(s) +3FeO(s) = Al2O3(s) + 3Fe (s) △H =" -3462" kJ/mol (3分)
试题分析:由题干信息可知,A、B、C、D分别为C、N、Al、Fe。
(1)Fe位于周期表第四周期,第Ⅷ族,价电子排布式为3d64s2;
(2)Na3N为离子晶体;NH3易溶于水主要原因是可以与水分子形成氢键;
(3)a、非金属性强弱与单质状态无关;错误
b、非金属性强的对电子对的吸引能力大,共用电子对则偏向该元素;正确
c、最高价氧化物对应水化物的酸性越强则非金属性越强,正确
d、非金属性强弱与酸反应难易无关,错误。
(4)热化学反应方程式的书写,注意物质的状态。

练习册系列答案
相关题目
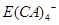 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.