题目内容
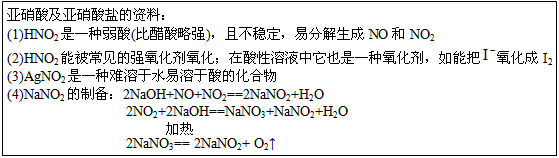
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),
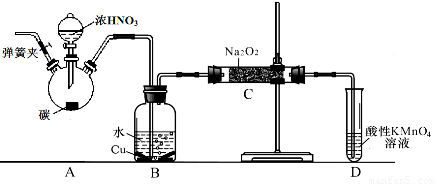
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1)??????? 。
(2)D装置的作用是??????? 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是?????? 。
A.亚硝酸盐是还原剂????????????? ????????????? ????????????? ? B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+????????????? ????????????? ????????????? ? D.亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是?????????
A .测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法??
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式??????????????????????????????????????????? 。
(1)2NO + Na2O2 =2NaNO2??? (2分)
(2)除去未反应的NO,防止污染空气? (2分)
(3)碱石灰? (2分)
(4)A? (2分)
(5)E? (2分)
(6)NO2- +Br2 +H2O=NO3-+2Br-+2H+??? (2分)
【解析】
试题分析:(1)Na2O2有强氧化性,而NO有还原性,所以二者会发生氧化还原反应,2NO + Na2O2 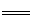 2NaNO2 ;
2NaNO2 ;
(2)NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸,所以答案是除去未反应的NO,防止污染空气;
(3)有碳酸钠和氢氧化钠,说明气体中混有二氧化碳和水蒸汽,所以加入碱石灰来除去干扰。
(4)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以A 错误。
(5)亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A可以;加酸,可以让NO2-+H+ HNO2,HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O,一氧化氮遇到氧气生成红棕色的二氧化氮,而氯化钠没有现象,故B可以;亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故C可以;在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故D可以;综上所述,所以选E;
HNO2,HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O,一氧化氮遇到氧气生成红棕色的二氧化氮,而氯化钠没有现象,故B可以;亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故C可以;在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故D可以;综上所述,所以选E;
(6)观察到溴水褪色,说明溴水被亚硝酸钠还原,再根据生成了NaNO3和HBr,反应的离子方程式是:NO2- +Br2 +H2O=NO3-+2Br-+2H+ 。
考点:考查亚硝酸盐的性质。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案