摘要:29.A.B.C.D.E.F为原子序数依次增大的短周期主族元素.A.F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍,B原子核外电子分处3个不同能级.且每个能级上排布的电子数相同,A与C形成的最简单分子为三角锥形,D原子p轨道上成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对.E电负性小于F. (1)写出B的基态原子的核外电子排布式 . (2)A.C形成的最简单分子极易溶于水.其主要原 因是 ,与该最简单分子互为等电子体的 阳离子为 . (3)比较E.F的第一电离能:E F. (4) BD.在高温高压下所形成的晶胞如右图所示.该晶体的类型属于 (选填“分子 .“原子 .“离子 或“金属 )晶体.该晶体中B原子的杂化形式为 . (5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成.则[F(OH)4]-中存在 . a.极性键 b.非极性键 c.配位键 d.键 e.π键
网址:http://m.1010jiajiao.com/timu3_id_428576[举报]
A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题:
(1)C的离子结构示意图为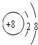
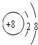 ;D与E两元素的离子半径:D
;D与E两元素的离子半径:D
(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为
查看习题详情和答案>>
(1)C的离子结构示意图为
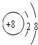
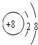
<
<
E(填“>”、“<”或“=”).(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
CH3-CH3
CH3-CH3
.(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
<
<
7(填“>”、“<”或“=”).化合物AB3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式2HN3=H2↑+3N2↑
2HN3=H2↑+3N2↑
.(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为
NH4Al(SO4)2
NH4Al(SO4)2
.A、B、C、D、E、F为原子序数递增的六种短周期元素;已知:A、B、C、D是组成蛋白质的基本元素;E和D可形成离子个数比均为2:1的两种化合物,F是地壳中含量最多的金属元素.
(1)写出B在周期表位置: ;D与E形成原子个数为1:1的化合物电子式: ;
(2)A与C能形成原子个数比为4:2的分子,写出该分子的结构式: ;
(3)Se是人体必需的微量元素,与D同一主族,且比.D多2个电子层,则Se的原子序数为 ;它与同族第三周期元素的最高价氧化物对应水化物的酸性强弱比较(用化学式表示): ;
(4)用F单质作阳极,石墨作阴极,NaHCO3溶液作电解液,进行电解,阳极观察到现象有: ,用电极反应方程式解释其原因: .
查看习题详情和答案>>
(1)写出B在周期表位置:
(2)A与C能形成原子个数比为4:2的分子,写出该分子的结构式:
(3)Se是人体必需的微量元素,与D同一主族,且比.D多2个电子层,则Se的原子序数为
(4)用F单质作阳极,石墨作阴极,NaHCO3溶液作电解液,进行电解,阳极观察到现象有:
A、B、C、D、E、F为原子序数依次增大的短周期主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层少4个;E元素原子次外层电子数比最外层多3个.
(1)写出下列元素的符号:A ,E .
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是 .
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是 .
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为 .
查看习题详情和答案>>
(1)写出下列元素的符号:A
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为
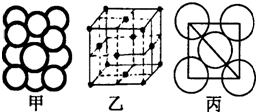 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外P电子数比S电子数少l个;
C原子的第一至第四电离能为:I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol;
D原子核外所有P轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元索在周期表位置:
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为:
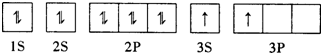
该同学所画的轨道式违背了
(3)已知BA5为离子化合物,写出其电子式:
(4)DE3中心原子杂化方式为
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙;则晶胞中该原子配位数为
(已知该金属相对原子质量为m,原子半径为a cm)
A、B、C、D、E、F为原子序数依次增大的同一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E.G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为 .
(2)D的原子结构示意图为 .
(3)用电子式表示出B、F形成化合物的过程: .
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答).
(5)实验室制备G的氢化物的化学方程式: .
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是 .
②相应的化学方程式: .
查看习题详情和答案>>
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的过程:
(4)以上元素中原子半径最大的是
(5)实验室制备G的氢化物的化学方程式:
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式: