摘要: CHCOOH是一种弱酸.而氯乙酸(CHCLCOOH)的酸性强于CHCOOH.这是因为-CL是一种强吸引电子基团.能使-OH上的H 原子具有更大的活动性.有的基团属于斥电子基团.能减弱-OH上H 原子的活动性.这种作用叫“诱导效应 . 根据以上规律判断: (1). HCOOH 显酸性.而HO 呈中性.这是由于HCOOH分子中存在 电子基团. 这种基团是 . 吸.羧基 斥.羟基 (2). CHCOOH 的酸性弱于HCOOH.这是由于CHCOOH 分子中存在(斥)电子基团. 这种基团是. 请判断: (3). 也属于吸电子基团.所以酸性比乙酸的酸性 . (填 1---“强 或 2---“弱 ).
网址:http://m.1010jiajiao.com/timu3_id_42675[举报]
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:
(2)写出E元素的元素符号: ,其价电子排布图为:
(3)A与D形成化合物的化学式为 ,是 分子(填“极性”或“非极性”)
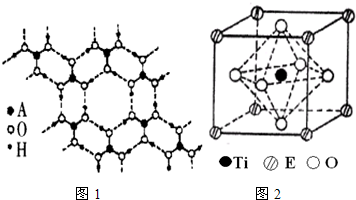
(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是 ,该晶体属于 晶体.
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为 个、 个.
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为 ,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是 ,E的配位数是 .
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:
(3)A与D形成化合物的化学式为

(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为
(2013?烟台模拟)CO与H2二者发生如下的化学反应:CO(g)+2H2(g)?CH4O(g)△H<0,该反应的产物甲醇是化学工业重要的基础原料.
(1)该反应中氧化剂是
(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
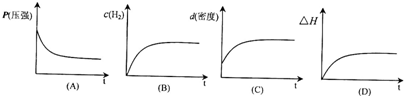
下列表示该反应过程的示意图正确的是
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
与稀释前比较
A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是
查看习题详情和答案>>
(1)该反应中氧化剂是
CO
CO
.相同温度下,1molCO完全燃烧的焓变为△H1,1molCH4O(g)完全燃烧的焓变为△H2,则△H1与△H2的关系为△H1>
>
△H2(填“>”、“<”或“=”).(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
0.06mol/(L.min)
0.06mol/(L.min)
,化学平衡常数K=9.375(mol/L)-2
9.375(mol/L)-2
.下列表示该反应过程的示意图正确的是
A
A
(填字母).
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
增大
增大
(填“增大”、“减小”、“不变”).(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
| [HCOO-] | [HCOOH]?[OH-] |
C
C
(填字母)A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
C
C
(填字母).A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是
混合后溶液中Qc=Ka
混合后溶液中Qc=Ka
.(2012?安徽)氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ?mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1
在20mL 0.1mol?L-1氢氟酸中加入V mL 0.1mol?L-1 NaOH溶液.下列有关说法正确的是( )
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ?mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1
在20mL 0.1mol?L-1氢氟酸中加入V mL 0.1mol?L-1 NaOH溶液.下列有关说法正确的是( )
查看习题详情和答案>>
(2011?黄山模拟)水是生命之源.饮用水消毒剂作为控制水质的一个重要环节,令世人关注.
(1)液氯消毒是最早的饮用水消毒方法.氯气溶于水能杀菌消毒的原因是:
臭氧(O3)是优良的水消毒剂.但当水中含溴离子(Br-)时,臭氧可氧化溴离子(Br-)为溴酸盐(BrO3-).而溴酸盐 (BrO3-)是对人体有致癌作用的化合物,我国规定饮用水中BrO3-含量在10μg/L以下.测定BrO3-浓度可用离子色谱法.
(2)水中的氯离子(Cl-)对BrO3-测定干扰很大,需要先除去氯离子(Cl-).用如图的装置可除去水中的氯离子(Cl-).装置中Ag是
Ag电极的电极反应式是
(3)O3氧化溴离子的原理如下:

已知HBrO是一种弱酸,O3与HBrO反应很慢,BrO3-主要是由BrO-与O3反应生成.
对影响生成BrO3-速率的因素提出如下假设:(请你完成假设②和假设③)
假设①:反应的温度.
假设②:
假设③:
(4)设计实验验证假设①.
验证实验操作:
a.配制250mL 50mg/L KBr溶液,加入 15mL 某种pH=7的缓冲溶液(维持溶液的pH基本不变),并将溶液分为2份.
b.
实验中要测定的量是
实验结论是
查看习题详情和答案>>
(1)液氯消毒是最早的饮用水消毒方法.氯气溶于水能杀菌消毒的原因是:
生成的HClO具有强氧化性,可以杀菌
生成的HClO具有强氧化性,可以杀菌
.近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害.臭氧(O3)是优良的水消毒剂.但当水中含溴离子(Br-)时,臭氧可氧化溴离子(Br-)为溴酸盐(BrO3-).而溴酸盐 (BrO3-)是对人体有致癌作用的化合物,我国规定饮用水中BrO3-含量在10μg/L以下.测定BrO3-浓度可用离子色谱法.

(2)水中的氯离子(Cl-)对BrO3-测定干扰很大,需要先除去氯离子(Cl-).用如图的装置可除去水中的氯离子(Cl-).装置中Ag是
阳
阳
极(填电极名称),Ag电极的电极反应式是
Ag+Cl-+e-=AgCl
Ag+Cl-+e-=AgCl
.(3)O3氧化溴离子的原理如下:

已知HBrO是一种弱酸,O3与HBrO反应很慢,BrO3-主要是由BrO-与O3反应生成.
对影响生成BrO3-速率的因素提出如下假设:(请你完成假设②和假设③)
假设①:反应的温度.
假设②:
溶液的pH
溶液的pH
假设③:
Br- 的浓度(或通入O3的速率)
Br- 的浓度(或通入O3的速率)
(4)设计实验验证假设①.
验证实验操作:
a.配制250mL 50mg/L KBr溶液,加入 15mL 某种pH=7的缓冲溶液(维持溶液的pH基本不变),并将溶液分为2份.
b.
分别在不同温度下,(以相同的速率)通入O3 (相同时间)
分别在不同温度下,(以相同的速率)通入O3 (相同时间)
实验中要测定的量是
分别测定相同时间内生成BrO3-的浓度
分别测定相同时间内生成BrO3-的浓度
实验结论是
若测得BrO3-的浓度不同,则假设①正确,若测得BrO3- 的浓度相同,则假设①不正确
若测得BrO3-的浓度不同,则假设①正确,若测得BrO3- 的浓度相同,则假设①不正确
.