题目内容
(2013?烟台模拟)CO与H2二者发生如下的化学反应:CO(g)+2H2(g)?CH4O(g)△H<0,该反应的产物甲醇是化学工业重要的基础原料.
(1)该反应中氧化剂是
(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
下列表示该反应过程的示意图正确的是
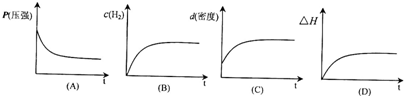
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
与稀释前比较
A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是
(1)该反应中氧化剂是
CO
CO
.相同温度下,1molCO完全燃烧的焓变为△H1,1molCH4O(g)完全燃烧的焓变为△H2,则△H1与△H2的关系为△H1>
>
△H2(填“>”、“<”或“=”).(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
0.06mol/(L.min)
0.06mol/(L.min)
,化学平衡常数K=9.375(mol/L)-2
9.375(mol/L)-2
.下列表示该反应过程的示意图正确的是
A
A
(填字母).
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
增大
增大
(填“增大”、“减小”、“不变”).(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
| [HCOO-] | [HCOOH]?[OH-] |
C
C
(填字母)A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
C
C
(填字母).A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是
混合后溶液中Qc=Ka
混合后溶液中Qc=Ka
.分析:(1)反应中C元素的化合价由+2价降低为-2价,CO完全燃烧生成二氧化碳,而CH4O完全燃烧生成二氧化碳和水,则放出的热量多;
(2)CO(g)+2H2(g)?CH4O(g),利用三段法计算出各个量,然后计算反应速率和化学平衡常数;
由反应可知,随反应的进行,P在减小,氢气的浓度在减小,密度不变,反应为放热反应,△H在变小;
(3)①甲酸为弱酸,稀释时Ka不变,则
=
;
②25℃,将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,Qc=Ka.
(2)CO(g)+2H2(g)?CH4O(g),利用三段法计算出各个量,然后计算反应速率和化学平衡常数;
由反应可知,随反应的进行,P在减小,氢气的浓度在减小,密度不变,反应为放热反应,△H在变小;
(3)①甲酸为弱酸,稀释时Ka不变,则
| [HCOO-] |
| [HCOOH]?[OH-] |
| Ka |
| KW |
②25℃,将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,Qc=Ka.
解答:解:(1)反应中C元素的化合价由+2价降低为-2价,则CO为氧化剂,CO完全燃烧生成二氧化碳,而CH4O完全燃烧生成二氧化碳和水,则放出的热量多,即△H1>△H2,故答案为:CO;>;
(2)CO(g)+2H2(g)?CH4O(g),
开始0.5 1 0
转化0.3 0.6 0.3
平衡0.2 0.4 0.3
则0~10min内的平均速率v(H2)=
=0.06mol/(L.min),
化学平衡常数K=
=9.375(mol/L)-2,
由反应可知,随反应的进行,P在减小,氢气的浓度在减小,密度不变,反应为放热反应,△H在变小,则只有图象A符合,
开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,压强增大,平衡正向移动,则CO的转化率增大,
故答案为:0.06mol/(L.min);9.375(mol/L)-2;A;增大;
(3)①甲酸为弱酸,稀释时Ka不变,则
=
,则比值不变,故答案为:C;
②25℃,将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,氢离子的物质的量为原来的2倍,但溶液的体积为原来的2倍,则Qc=Ka,所以电离平衡HCOOH?HCOO-+H+不移动,故答案为:C;混合后溶液中Qc=Ka.
(2)CO(g)+2H2(g)?CH4O(g),
开始0.5 1 0
转化0.3 0.6 0.3
平衡0.2 0.4 0.3
则0~10min内的平均速率v(H2)=
| 0.6mol/L |
| 10min |
化学平衡常数K=
| 0.3 |
| 0.2×0.42 |
由反应可知,随反应的进行,P在减小,氢气的浓度在减小,密度不变,反应为放热反应,△H在变小,则只有图象A符合,
开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,压强增大,平衡正向移动,则CO的转化率增大,
故答案为:0.06mol/(L.min);9.375(mol/L)-2;A;增大;
(3)①甲酸为弱酸,稀释时Ka不变,则
| [HCOO-] |
| [HCOOH]?[OH-] |
| Ka |
| KW |
②25℃,将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,氢离子的物质的量为原来的2倍,但溶液的体积为原来的2倍,则Qc=Ka,所以电离平衡HCOOH?HCOO-+H+不移动,故答案为:C;混合后溶液中Qc=Ka.
点评:本题考查知识点较多,为综合题,涉及氧化还原反应、反应与能量、化学平衡及计算、电离平衡等,注重高考常考考点的考查,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目