摘要:20. (1) . . (2) . . (3) g. (4) g.
网址:http://m.1010jiajiao.com/timu3_id_424636[举报]
Ⅰ.如图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出仪器A、C、E的名称
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:
Ⅱ.实验室用固体烧碱配制200mL 0.5mol?L-1的NaOH溶液.
(1)需称量
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有
(3)请描述定容操作应采取的具体方法
查看习题详情和答案>>

(1)写出仪器A、C、E的名称
蒸馏烧瓶、分液漏斗、冷凝管
蒸馏烧瓶、分液漏斗、冷凝管
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:
AE
AE
汽油和水:C
C
Ⅱ.实验室用固体烧碱配制200mL 0.5mol?L-1的NaOH溶液.
(1)需称量
5.0
5.0
g 烧碱,应放在烧杯
烧杯
中称量、溶解.(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有
250mL容量瓶、胶头滴管
250mL容量瓶、胶头滴管
(3)请描述定容操作应采取的具体方法
向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切
向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切
. Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生反应:N2(g)+3H2(g)
Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生反应:N2(g)+3H2(g) 2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1mol,c=2mol,则b=
3
3
mol,在此情况下,反应起始时将向逆
逆
方向进行(填“正”或“逆”)(2)若规定起始时反应向逆反应方向进行,则c的取值范围是
1<c<4
1<c<4
.(3)在上述装置中,若需控制平衡后混和气体的物质的量为6.5mol,则可采取的措施是
降低温度
降低温度
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2mol SO2和1mol O2,在B中充入2mol SO3和 1mol N2,在相同条件下发生可逆反应:2SO2(g)+O2(g)
 2SO3(g).根据下列要求填写空白:
2SO3(g).根据下列要求填写空白:(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA
<
<
PB(填“<”、“=”、“>”).
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在
3
3
处.(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x和y 的关系是
x
<
<
y.(填“<”、“=”、“>”).Ⅰ.在一个固定容积的密闭容器中,在一定温度下发生下列反应:
A(g)+B(g) 2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为
(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A
(3)若在相同容器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是
Ⅱ.某密闭容器中有如下可逆反应:2SO2 (g)+O2 (g) 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
(1)升高温度,v(正)
(2)加正催化剂,v(正)
(3)保持容器内的压强不变,向容器中充入氩气,SO3的体积分数
查看习题详情和答案>>
A(g)+B(g)
 2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为
2p
2p
mol/L;(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A
0.25
0.25
mol,B0.75
0.75
mol;(3)若在相同容器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是
a+
c=1,b-a=1
| 1 |
| 2 |
a+
c=1,b-a=1
(其中一个只含a和b,另一个只含a和c).| 1 |
| 2 |
Ⅱ.某密闭容器中有如下可逆反应:2SO2 (g)+O2 (g)
 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.(1)升高温度,v(正)
增大
增大
,v(逆)增大
增大
,SO2 的转化率减小
减小
.(2)加正催化剂,v(正)
增大
增大
,v(逆)增大
增大
,O2 的物质的量不变
不变
.(3)保持容器内的压强不变,向容器中充入氩气,SO3的体积分数
增大
增大
,SO2的浓度减小
减小
.Ⅰ.盖斯定律内容:
如图所示
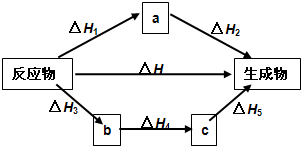
△H=
Ⅱ.(5分)若已知 H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+1/2O2(g)=H2O(l) 的焓变△H3可分两步
①在方框中填上化学式及状态

②求△H3
Ⅲ.(3分)已知在卫星发射时可用肼(N2H4)为燃料,NO2作氧化剂,二者反应生成N2和气态H2O(g).又知:
1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
写出2N2H4+2NO2=3N2+4H2O反应的热化学方程式
查看习题详情和答案>>
对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的
对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的
也就是说反应焓变(反应热效应)只与初始状态
初始状态
、终了状态
终了状态
有关,与反应过程
反应过程
无关.如图所示

△H=
△H1+△H2
△H1+△H2
=△H3+△H4+△H5
△H3+△H4+△H5
Ⅱ.(5分)若已知 H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+1/2O2(g)=H2O(l) 的焓变△H3可分两步
①在方框中填上化学式及状态

②求△H3
△H1+△H2
△H1+△H2
=-285.8kJ/mol
-285.8kJ/mol
(求具体数值)Ⅲ.(3分)已知在卫星发射时可用肼(N2H4)为燃料,NO2作氧化剂,二者反应生成N2和气态H2O(g).又知:
1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
写出2N2H4+2NO2=3N2+4H2O反应的热化学方程式
N2H4 (g)+3/2NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol
N2H4 (g)+3/2NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol
.Ⅰ.将70mL NO和O2的混合气体通入足量的水中.(1)若正好完全反应生成HNO3,则原混合气体中O2和NO各多少毫升?(2)若在相同条件下收集到7mL剩余气体,则原混合气体中O2和NO各多少毫升?
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
(2)写出反应①的离子反应方程式:
写出反应③的离子反应方程式:
(3)写出反应②的化学方程式:
(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:
查看习题详情和答案>>
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
NaOH
NaOH
;F的化学式为N2
N2
;(2)写出反应①的离子反应方程式:
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
;写出反应③的离子反应方程式:
3NO2+H2O═2H++2NO3-+NO
3NO2+H2O═2H++2NO3-+NO
.(3)写出反应②的化学方程式:
Ag+2HNO3═AgNO3+NO2↑+H2O
Ag+2HNO3═AgNO3+NO2↑+H2O
.(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:
AgN3
AgN3
.