题目内容
Ⅰ.盖斯定律内容:
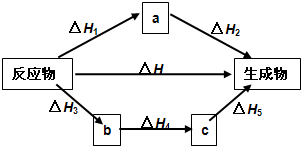
如图所示
△H=
Ⅱ.(5分)若已知 H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+1/2O2(g)=H2O(l) 的焓变△H3可分两步
①在方框中填上化学式及状态

②求△H3
Ⅲ.(3分)已知在卫星发射时可用肼(N2H4)为燃料,NO2作氧化剂,二者反应生成N2和气态H2O(g).又知:
1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
写出2N2H4+2NO2=3N2+4H2O反应的热化学方程式
对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的
对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的
也就是说反应焓变(反应热效应)只与初始状态
初始状态
、终了状态
终了状态
有关,与反应过程
反应过程
无关.如图所示

△H=
△H1+△H2
△H1+△H2
=△H3+△H4+△H5
△H3+△H4+△H5
Ⅱ.(5分)若已知 H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+1/2O2(g)=H2O(l) 的焓变△H3可分两步
①在方框中填上化学式及状态

②求△H3
△H1+△H2
△H1+△H2
=-285.8kJ/mol
-285.8kJ/mol
(求具体数值)Ⅲ.(3分)已知在卫星发射时可用肼(N2H4)为燃料,NO2作氧化剂,二者反应生成N2和气态H2O(g).又知:
1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
写出2N2H4+2NO2=3N2+4H2O反应的热化学方程式
N2H4 (g)+3/2NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol
N2H4 (g)+3/2NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol
.分析:Ⅰ、依据盖斯定律概念和含义分析,反应焓变与初始状态和终了状态有关,与变化过程无关,分析图示计算焓变;
Ⅱ、①依据盖斯定律分析判断,反应H2(g)+
O2(g)=H2O(l) 的焓变△H3可分两步,氢气和氧气反应直接生成液态水,也可以先生成气体水;气态变化为液态水
,据此填表,依据热化学方程式和盖斯定律计算焓变;
②依据热化学方程式和盖斯定律就得到所需热化学方程式;
Ⅲ、依据盖斯定律和热化学方程式计算得到所需热化学方程式;
Ⅱ、①依据盖斯定律分析判断,反应H2(g)+
| 1 |
| 2 |
,据此填表,依据热化学方程式和盖斯定律计算焓变;
②依据热化学方程式和盖斯定律就得到所需热化学方程式;
Ⅲ、依据盖斯定律和热化学方程式计算得到所需热化学方程式;
解答:解:Ⅰ.盖斯定律的内容是对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,反应的焓变只与初始状态和终了状态有关,与变化过程和途径无关;分析图示可知反应可以通过三种途径完成,但反应过程中的焓变是相同的,△H=△H1+△H2=△H3+△H4+△H5;
故答案为:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,初始状态,终了状态,反应过程,△H1+△H2,△H3+△H4+△H5;
Ⅱ.①若已知 H2(g)+
2O2(g)=H2O(g)△H1=-241.8kJ/mol,H2O(g)=H2O(l)△H2=-44.0kJ/mol
求反应H2(g)+
O2(g)=H2O(l) 的焓变△H3可分两步,氢气和氧气反应直接生成液态水,也可以先生成气体水,
写入转化关系图为: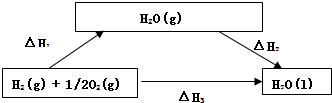 ;
;
故答案为: ;
;
②①H2(g)+
O2(g)=H2O(g)△H1=-241.8kJ/mol,②H2O(g)=H2O(l)△H2=-44.0kJ/mol
依据盖斯定律和热化学方程式计算,①+②得到:H2(g)+
O2(g)=H2O(l)△H=△H1+△H2=-241.8KJ/mol+(-44KJ/mol)=-285.8KJ/mol;
故答案为:△H1+△H2,-285.8kJ/mol;
Ⅲ.1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
依据盖斯定律②-①得到:N2H4 (g)+
NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol;
故答案为:N2H4 (g)+
NO2(g)=N2(g)+2H2O(g)△H=-567.8kJ/mol;
故答案为:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,初始状态,终了状态,反应过程,△H1+△H2,△H3+△H4+△H5;
Ⅱ.①若已知 H2(g)+
| 1 |
| 2 |
求反应H2(g)+
| 1 |
| 2 |
写入转化关系图为:
 ;
;故答案为:
 ;
;②①H2(g)+
| 1 |
| 2 |
依据盖斯定律和热化学方程式计算,①+②得到:H2(g)+
| 1 |
| 2 |
故答案为:△H1+△H2,-285.8kJ/mol;
Ⅲ.1/2N2(g)+O2(g)=NO2(g)△H1=+33.8kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol ②
依据盖斯定律②-①得到:N2H4 (g)+
| 3 |
| 2 |
故答案为:N2H4 (g)+
| 3 |
| 2 |
点评:本题考查了热化学方程式和盖斯定律的理解和计算应用,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
 (1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.