摘要:28. ①Fe2+ ; Fe3+.Cu2+ 2Fe3+ +Fe =3Fe2+ Cu2+ + Fe =Fe2+ +Cu ② Fe2+ ,Cu2+ 0≤n(Cu2+)<0.1mol ③ Fe2+ .Cu2+ ⑵ ①沉淀全是Fe(OH)3为0.06mol ②0≤X≤0.6
网址:http://m.1010jiajiao.com/timu3_id_424530[举报]
某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol?L-1FeCl3溶液、0.1mol?L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的氧化性、还原性,并对实验结果加于应用.
(1)兴趣小组通过对Fe2+、Fe3+的价态分析,对Fe2+、Fe3+的氧化性、还原性提出了如下3种假设:
假设一:Fe2+ 具有
假设二:Fe2+ 具有
假设三:Fe3+ 具有
(2)设计实验方案,进行试验并描述实验现象,完成下列表格.
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2+Zn═ZnCl2+Fe该反应的离子方程式为:
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:
查看习题详情和答案>>
(1)兴趣小组通过对Fe2+、Fe3+的价态分析,对Fe2+、Fe3+的氧化性、还原性提出了如下3种假设:
假设一:Fe2+ 具有
还原
还原
性;假设二:Fe2+ 具有
氧化
氧化
性;假设三:Fe3+ 具有
氧化
氧化
性;(2)设计实验方案,进行试验并描述实验现象,完成下列表格.
| 探究内容 | 实验方案 | 实验现象 | 写出下列离子方程式 |
| 探究Fe2+具有还原性 | 取少量0.1mol?L-1FeCl溶液,加入少量KSCN溶液后,再往溶液中加入少量 新制氯水 新制氯水 |
溶液先不变红,后变为血红色 | ①Fe2+发生的反应: 2Fe2++Cl2=2Fe3++2Cl- 2Fe2++Cl2=2Fe3++2Cl- |
| 探究Fe3+具有氧化性 | 取少量0.1mol?L-1FeCl溶液,加入足量 铁粉 铁粉 后,再往溶液中加入少量KSCN溶液 |
溶液不变为血红色 | Fe3+发生的反应: 2Fe3++Fe=3Fe2+ 2Fe3++Fe=3Fe2+ |
Zn+Fe2+=Fe+Zn2+
Zn+Fe2+=Fe+Zn2+
.(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用.按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.

(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200mL,其中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1,若要将铜全部回收,需加入Fe粉的质量应不少于
查看习题详情和答案>>

(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
2FeCl3+Cu=2FeCl2+CuCl2
2FeCl3+Cu=2FeCl2+CuCl2
.(2)检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
.(3)“过滤”用到的玻璃仪器有:普通漏斗、
玻璃棒、烧杯
玻璃棒、烧杯
.(4)废液中加入过量①后,发生反应的离子方程式:
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu
.(5)上述流程中取废液200mL,其中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1,若要将铜全部回收,需加入Fe粉的质量应不少于
22.4
22.4
g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于0.6
0.6
mol.印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:
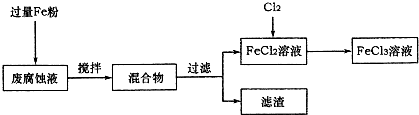
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
②检验废腐蚀液中含有Fe3+的实验操作是
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
③由滤渣得到纯铜,除杂所需试剂是
(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
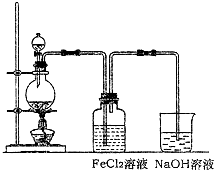
①实验开始前,某同学对实验装置进行了气密性检查,方法是
②浓盐酸与二氧化锰反应的化学方程式为
烧杯中NaOH溶液的作用是
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
查看习题详情和答案>>
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
;②检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
漏斗
漏斗
.③由滤渣得到纯铜,除杂所需试剂是
盐酸
盐酸
.(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.

①实验开始前,某同学对实验装置进行了气密性检查,方法是
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
.②浓盐酸与二氧化锰反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
烧杯中NaOH溶液的作用是
吸收多余氯气,防止尾气处理
吸收多余氯气,防止尾气处理
.③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g,需通入Cl2的物质的量应不少于0.75
0.75
mol.一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
[探究目的]
从废液中回收铜,并重新得到FeCl3溶液.
[资料获悉]
①3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe3+:2.7~3.7Cu2+:5.2~6.4Fe2+:7.6~9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeCl3溶液.
[实验探究]
取几滴废液于试管中加水稀释后,滴加KSCN溶液出现血红色,可知废液中除含有Fe2+、Cu2+外,还含有Fe3+.
甲同学取10mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称重8.61g.乙同学另取10mL废液,加入某试剂将pH调至4.0,使其中Fe3+转化为Fe(OH)3沉淀,而Fe2+、Cu2+仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32g.
通过计算可知废液中c(Fe3+)=______mol/L,c(Fe2+)=______mol/L,c(Cu2+)=______mol/L.
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeC13溶液?
丙同学认为应该先向废液中加入wg铁粉[w=c(Cu2+)×1L×56g/mol],使之充分反应置换出铜,过滤,得金属铜.再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达实验目的.有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
(1)______(2)______(3)______
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的.(方案内容略)
[拓展延伸]
请画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用图象计算,当铜离子的物质的量减少一半时,加入铁粉的质量是______g.

查看习题详情和答案>>
[探究目的]
从废液中回收铜,并重新得到FeCl3溶液.
[资料获悉]
①3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe3+:2.7~3.7Cu2+:5.2~6.4Fe2+:7.6~9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeCl3溶液.
[实验探究]
取几滴废液于试管中加水稀释后,滴加KSCN溶液出现血红色,可知废液中除含有Fe2+、Cu2+外,还含有Fe3+.
甲同学取10mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称重8.61g.乙同学另取10mL废液,加入某试剂将pH调至4.0,使其中Fe3+转化为Fe(OH)3沉淀,而Fe2+、Cu2+仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32g.
通过计算可知废液中c(Fe3+)=______mol/L,c(Fe2+)=______mol/L,c(Cu2+)=______mol/L.
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeC13溶液?
丙同学认为应该先向废液中加入wg铁粉[w=c(Cu2+)×1L×56g/mol],使之充分反应置换出铜,过滤,得金属铜.再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达实验目的.有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
(1)______(2)______(3)______
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的.(方案内容略)
[拓展延伸]
请画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用图象计算,当铜离子的物质的量减少一半时,加入铁粉的质量是______g.

电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用.按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
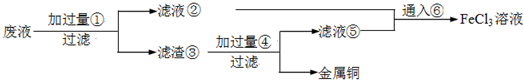
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200mL,其中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1,若要将铜全部回收,需加入Fe粉的质量应不少于
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
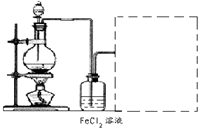
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂.
查看习题详情和答案>>

(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
2FeCl3+Cu=2FeCl2+CuCl2
2FeCl3+Cu=2FeCl2+CuCl2
.(2)检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
.(3)“过滤”用到的玻璃仪器有:普通漏斗、
玻璃棒、烧杯
玻璃棒、烧杯
.(4)废液中加入过量①后,发生反应的离子方程式:
2Fe3++Fe=3Fe2+Cu2++Fe=Fe2++Cu
2Fe3++Fe=3Fe2+Cu2++Fe=Fe2++Cu
.(5)上述流程中取废液200mL,其中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1,若要将铜全部回收,需加入Fe粉的质量应不少于
22.4
22.4
g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于0.6
0.6
mol.(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.

制备Cl2的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂.