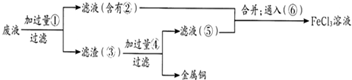
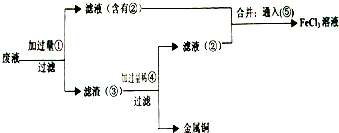
��Ŀ����
���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壮�ϸ�ʴҺ���д���CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ�Ӧ���ǻ������ã�������������ʵ���ҽ���ʵ�飺�ӷ�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã�
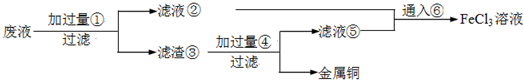
��1��д��FeCl3��Һ��ͭ��������Ӧ�Ļ�ѧ����ʽ��
��2������ϸ�ʴҺ�к���Fe3+��ʵ�������
��3�������ˡ��õ��IJ��������У���ͨ©����
��4����Һ�м�������ٺ�����Ӧ�����ӷ���ʽ��
��5������������ȡ��Һ200mL�����к�CuCl2 1.5mol?L-1��FeCl2 3.0mol?L-1��FeCl3 1.0mol?L-1����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������
��6��ij��ѧ��ȤС����������ͼװ����ȡ������ͨ�뵽FeCl2��Һ�л��FeCl3��Һ��
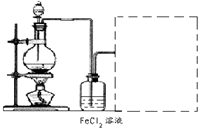
�Ʊ�Cl2�Ļ�ѧ����ʽΪ��
��װ�ò������������������߿��ڻ�����ȱ���֣�����ע�Լ���

��1��д��FeCl3��Һ��ͭ��������Ӧ�Ļ�ѧ����ʽ��
2FeCl3+Cu=2FeCl2+CuCl2
2FeCl3+Cu=2FeCl2+CuCl2
����2������ϸ�ʴҺ�к���Fe3+��ʵ�������
ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+
ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+
����3�������ˡ��õ��IJ��������У���ͨ©����
���������ձ�
���������ձ�
����4����Һ�м�������ٺ�����Ӧ�����ӷ���ʽ��
2Fe3++Fe=3Fe2+Cu2++Fe=Fe2++Cu
2Fe3++Fe=3Fe2+Cu2++Fe=Fe2++Cu
����5������������ȡ��Һ200mL�����к�CuCl2 1.5mol?L-1��FeCl2 3.0mol?L-1��FeCl3 1.0mol?L-1����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������
22.4
22.4
g�������Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������0.6
0.6
mol����6��ij��ѧ��ȤС����������ͼװ����ȡ������ͨ�뵽FeCl2��Һ�л��FeCl3��Һ��

�Ʊ�Cl2�Ļ�ѧ����ʽΪ��
MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O
| ||
MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O
��
| ||
��װ�ò������������������߿��ڻ�����ȱ���֣�����ע�Լ���
��������1���Ȼ�����ͭ��Ӧ�����Ȼ��������Ȼ�����
��2��������Һ��Fe3+����ͨ����KSCN��Һ����Һ���˵��Fe3+���ڣ�
��3�����˲����õ��IJ��������У�©�����ձ�����������
��4���ӷ�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã����Һ�мӹ����٣�Fe�ۣ�����ҺΪFeCl2������ΪFe��Cu�������мӹ����ܣ����ᣩ����Cu�������Ӧ������Һ��ΪFeCl2������Һ�ں͢���ͨ��ޣ��������ɷ�Ӧ�õ�FeCl3��Һ���ݴ˼��ɽ��
��5������2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu����
��6��ʵ������Ũ������������̷�Ӧ��ȡ�������ݴ���д��ѧ����ʽ�������ж������β��������
��2��������Һ��Fe3+����ͨ����KSCN��Һ����Һ���˵��Fe3+���ڣ�
��3�����˲����õ��IJ��������У�©�����ձ�����������
��4���ӷ�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã����Һ�мӹ����٣�Fe�ۣ�����ҺΪFeCl2������ΪFe��Cu�������мӹ����ܣ����ᣩ����Cu�������Ӧ������Һ��ΪFeCl2������Һ�ں͢���ͨ��ޣ��������ɷ�Ӧ�õ�FeCl3��Һ���ݴ˼��ɽ��
��5������2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu����
��6��ʵ������Ũ������������̷�Ӧ��ȡ�������ݴ���д��ѧ����ʽ�������ж������β��������
����⣺��1���Ȼ�����ͭ��Ӧ�����Ȼ��������Ȼ�������Ӧ����ʽΪ��2FeCl3+Cu�T2FeCl2+CuCl2��
�ʴ�Ϊ��2FeCl3+Cu�T2FeCl2+CuCl2��
��2��������Һ��Fe3+����ͨ����KSCN��Һ��ȡ������Һ���Թ��У��μ�KSCN��Һ��������ӦFe3++3SCN-?Fe��SCN��3����Һ��죬˵��Fe3+���ڣ�
�ʴ�Ϊ��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
��3���������õ��������У�����̨�����������ձ���©���ȣ������õ������ֲ���������©�����ձ������������ձ�����ʢ��Һ�壬©�����ڹ��ˣ����������������ͽ��裮
�ʴ�Ϊ���ձ�����������
��4����ʵ����ȡ�����Ȼ�����Һ����������������Һ�����Ȼ�������Һ���������������������������ͭ����ȡ�����Ȼ������ܽ������ܼ���Ӧ����������Է�Һ�м�������������������ӷ�ӦΪ2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
��5����2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu
0.2mol 0.1mol 0.3mol 0.3mol
��Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.4mol��56g/mol=22.4g��
��Ӧ��n��FeCl2��=0.3mol+0.3mol+0.6mol=1.2mol��
��2FeCl2+Cl2=2FeCl3��֪�����Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������
=0.6mol��
�ʴ�Ϊ��22.4��0.6��
��6��ʵ������Ũ������������̷�Ӧ��ȡ��������Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O�������ж������β��������Cl2+2NaOH=NaCl+NaClO+H2O����������������Һ����β�����գ���Ϊ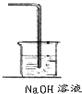 ��
��
�ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��2FeCl3+Cu�T2FeCl2+CuCl2��
��2��������Һ��Fe3+����ͨ����KSCN��Һ��ȡ������Һ���Թ��У��μ�KSCN��Һ��������ӦFe3++3SCN-?Fe��SCN��3����Һ��죬˵��Fe3+���ڣ�
�ʴ�Ϊ��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
��3���������õ��������У�����̨�����������ձ���©���ȣ������õ������ֲ���������©�����ձ������������ձ�����ʢ��Һ�壬©�����ڹ��ˣ����������������ͽ��裮
�ʴ�Ϊ���ձ�����������
��4����ʵ����ȡ�����Ȼ�����Һ����������������Һ�����Ȼ�������Һ���������������������������ͭ����ȡ�����Ȼ������ܽ������ܼ���Ӧ����������Է�Һ�м�������������������ӷ�ӦΪ2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
��5����2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu
0.2mol 0.1mol 0.3mol 0.3mol
��Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.4mol��56g/mol=22.4g��
��Ӧ��n��FeCl2��=0.3mol+0.3mol+0.6mol=1.2mol��
��2FeCl2+Cl2=2FeCl3��֪�����Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������
| 1.2mol |
| 2 |
�ʴ�Ϊ��22.4��0.6��
��6��ʵ������Ũ������������̷�Ӧ��ȡ��������Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��
| ||
 ��
���ʴ�Ϊ��MnO2+4HCl��Ũ��
| ||

���������⿼�黯ѧ�������̡����û�ѧ���Ԫ�ػ��������ʵȣ�����Ԫ�ػ�����������ǹؼ������ķ��롢�ᴿ������ע�⻯ѧ��Ӧԭ���ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ