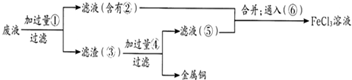
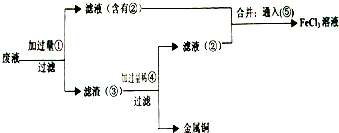
��Ŀ����
���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壮�ϸ�ʴҺ���д���CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ�Ӧ���ǻ������ã�������������ʵ���ҽ���ʵ�飺�ӷ�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã�

��1��д��FeCl3��Һ��ͭ��������Ӧ�Ļ�ѧ����ʽ��
��2������ϸ�ʴҺ�к���Fe3+��ʵ�������
��3�������ˡ��õ��IJ��������У���ͨ©����
��4����Һ�м�������ٺ�����Ӧ�����ӷ���ʽ��
��5������������ȡ��Һ200mL�����к�CuCl2 1.5mol?L-1��FeCl2 3.0mol?L-1��FeCl3 1.0mol?L-1����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������

��1��д��FeCl3��Һ��ͭ��������Ӧ�Ļ�ѧ����ʽ��
2FeCl3+Cu=2FeCl2+CuCl2
2FeCl3+Cu=2FeCl2+CuCl2
����2������ϸ�ʴҺ�к���Fe3+��ʵ�������
ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+
ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+
����3�������ˡ��õ��IJ��������У���ͨ©����
���������ձ�
���������ձ�
����4����Һ�м�������ٺ�����Ӧ�����ӷ���ʽ��
2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu
2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu
����5������������ȡ��Һ200mL�����к�CuCl2 1.5mol?L-1��FeCl2 3.0mol?L-1��FeCl3 1.0mol?L-1����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������
22.4
22.4
g�������Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������0.6
0.6
mol���������ӷ�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã����Һ�мӹ����٣�Fe�ۣ�����ҺΪFeCl2������ΪFe��Cu�������мӹ����ܣ����ᣩ����Cu�������Ӧ������Һ��ΪFeCl2������Һ�ں͢���ͨ��ޣ��������ɷ�Ӧ�õ�FeCl3��Һ��Ȼ����ʵ����̼���ѧ���������
����⣺�ӷ�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã����Һ�мӹ����٣�Fe�ۣ�����ҺΪFeCl2������ΪFe��Cu�������мӹ����ܣ����ᣩ����Cu�������Ӧ������Һ��ΪFeCl2������Һ�ں͢���ͨ��ޣ��������ɷ�Ӧ�õ�FeCl3��Һ��
��1��FeCl3��Һ��ͭ��Ӧ�����Ȼ�ͭ���Ȼ��������÷�ӦΪ2FeCl3+Cu=2FeCl2+CuCl2��
�ʴ�Ϊ��2FeCl3+Cu=2FeCl2+CuCl2��
��2��һ������KSCN��Һ�����������ӣ�ʵ�����Ϊȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
�ʴ�Ϊ��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
��3�����˲���ʹ�õ��ձ���©�������������ʴ�Ϊ�����������ձ���
��4����Һ�м�������ٺ��������ӷ�ӦΪ2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
��5����2Fe3++Fe=3Fe2+��
0.2mol 0.1mol
Cu2++Fe=Fe2++Cu
0.3mol 0.3mol
��Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.4mol��56g/mol=22.4g��
��Ӧ��n��FeCl2��=0.3mol+0.3mol+0.6mol=1.2mol��
��2FeCl2+Cl2=2FeCl3��֪�����Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������
=0.6mol��
�ʴ�Ϊ��22.4��0.6��
��1��FeCl3��Һ��ͭ��Ӧ�����Ȼ�ͭ���Ȼ��������÷�ӦΪ2FeCl3+Cu=2FeCl2+CuCl2��
�ʴ�Ϊ��2FeCl3+Cu=2FeCl2+CuCl2��
��2��һ������KSCN��Һ�����������ӣ�ʵ�����Ϊȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
�ʴ�Ϊ��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��
��3�����˲���ʹ�õ��ձ���©�������������ʴ�Ϊ�����������ձ���
��4����Һ�м�������ٺ��������ӷ�ӦΪ2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��
��5����2Fe3++Fe=3Fe2+��
0.2mol 0.1mol
Cu2++Fe=Fe2++Cu
0.3mol 0.3mol
��Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.4mol��56g/mol=22.4g��
��Ӧ��n��FeCl2��=0.3mol+0.3mol+0.6mol=1.2mol��
��2FeCl2+Cl2=2FeCl3��֪�����Ļ�����ȫ��ת��ΪFeCl3��Һ��ͨ��Cl2�����ʵ���������
| 1.2mol |
| 2 |
�ʴ�Ϊ��22.4��0.6��
������������ʵ�����ʽ��������ķ��롢�ᴿ��ע�ⷢ���Ļ�ѧ��Ӧ��Ԫ���غ�ĽǶ��������ǽ����Ĺؼ�����5��Ϊѧ�������״�����ѵ㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ