��Ŀ����
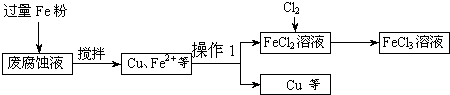
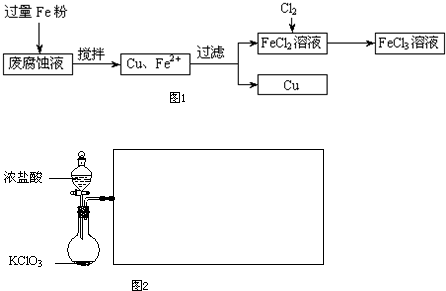
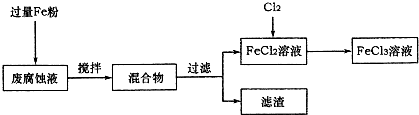
ӡˢ��·�ķϸ�ʴҺ���д���CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ��ɴӸ÷�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã�
��1�����ij�ϸ�ʴҺ�к�CuCl2 1.5mol?L-1��FeCl23.0 mol?L-1��FeCl3 1.0mol?L-1��HCl3.0mol?L-1��ȡ�ϸ�ʴҺ200mL������������ʵ���ҽ���ʵ�飺
�ش��������⣺
�ٷϸ�ʴҺ�м���������ۺ�����Ӧ�����ӷ���ʽΪ
�ڼ���ϸ�ʴҺ�к���Fe3+��ʵ�������
�����������У������ˡ��õ��IJ����������ձ�����������
���������õ���ͭ�����������Լ���
��2��ij��ѧ��ȤС��������ͼװ����ȡ������ͨ�뵽FeCl2��Һ�л��FeCl3��Һ��
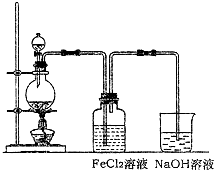
��ʵ�鿪ʼǰ��ijͬѧ��ʵ��װ�ý����������Լ�飬������
��Ũ������������̷�Ӧ�Ļ�ѧ����ʽΪ
�ձ���NaOH��Һ��������
�۲ο���1�������ݣ����������̲��������ȡFe�۵�����Ӧ������
��1�����ij�ϸ�ʴҺ�к�CuCl2 1.5mol?L-1��FeCl23.0 mol?L-1��FeCl3 1.0mol?L-1��HCl3.0mol?L-1��ȡ�ϸ�ʴҺ200mL������������ʵ���ҽ���ʵ�飺

�ش��������⣺
�ٷϸ�ʴҺ�м���������ۺ�����Ӧ�����ӷ���ʽΪ
2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��2H++Fe=Fe2++H2��
2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��2H++Fe=Fe2++H2��
���ڼ���ϸ�ʴҺ�к���Fe3+��ʵ�������
ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+
ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+
�������������У������ˡ��õ��IJ����������ձ�����������
©��
©��
�����������õ���ͭ�����������Լ���
����
����
����2��ij��ѧ��ȤС��������ͼװ����ȡ������ͨ�뵽FeCl2��Һ�л��FeCl3��Һ��

��ʵ�鿪ʼǰ��ijͬѧ��ʵ��װ�ý����������Լ�飬������
�رշ�Һ©�������������ܲ���ˮ�У�����������ƿ�����ܿ�������ð�����ɿ��ֵ����ڳ���һ��ˮ����֤������������
�رշ�Һ©�������������ܲ���ˮ�У�����������ƿ�����ܿ�������ð�����ɿ��ֵ����ڳ���һ��ˮ����֤������������
����Ũ������������̷�Ӧ�Ļ�ѧ����ʽΪ
MnO2+4HCl��Ũ��
��MnCl2+Cl2��+2H2O
| ||
MnO2+4HCl��Ũ��
��MnCl2+Cl2��+2H2O
��
| ||
�ձ���NaOH��Һ��������
���ն�����������ֹβ������
���ն�����������ֹβ������
���۲ο���1�������ݣ����������̲��������ȡFe�۵�����Ӧ������
39.2
39.2
g����ͨ��Cl2�����ʵ���Ӧ������0.75
0.75
mol����������1���ٷ�Һ�к���Fe3+��Cu2+��H+�������۷�Ӧ��
����KSCN��Һ�����������ӣ����ݹ��˲���������
�۸���ͭ���л������ۣ�
��2����ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ���������������ݵ����ɡ�ˮ�����γɡ�Һ��������ȣ����ж�װ�������ԣ�
�ڸ��ݷ�Ӧ���������д������ʽ�������ж�������������Һ���գ�
�۸�������CuCl2��FeCl3��HCl��Ӧ����μӷ�Ӧ�����۵�����������Cl2��FeCl2��Ӧ����FeCl3�����Cl2�����ʵ�����
����KSCN��Һ�����������ӣ����ݹ��˲���������
�۸���ͭ���л������ۣ�
��2����ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ���������������ݵ����ɡ�ˮ�����γɡ�Һ��������ȣ����ж�װ�������ԣ�
�ڸ��ݷ�Ӧ���������д������ʽ�������ж�������������Һ���գ�
�۸�������CuCl2��FeCl3��HCl��Ӧ����μӷ�Ӧ�����۵�����������Cl2��FeCl2��Ӧ����FeCl3�����Cl2�����ʵ�����
����⣺��1���ٷ�Һ�к���Fe3+��Cu2+��H+����������ۺ��������ӷ�ӦΪ2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��2H++Fe=Fe2++H2����
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��2H++Fe=Fe2++H2����
��һ����KSCN��Һ�����������ӣ�ʵ�����Ϊȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+�����˲���ʹ�õ��ձ���©������������
�ʴ�Ϊ��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��©����
����ͭ���л������ۣ������������ȥ���ۣ��ʴ�Ϊ��HCl��
��2����ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ���������������ݵ����ɡ�ˮ�����γɡ�Һ��������ȣ����ж�װ�������ԣ��ʴ�Ϊ���رշ�Һ©�������������ܲ���ˮ�У�����������ƿ�����ܿ�������ð�����ɿ��ֵ����ڳ���һ��ˮ����֤�����������ã�
��Ũ������������̷�Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��
��MnCl2+Cl2��+2H2O��������һ���ж������壬���йص�ʵ��ʱҪ����β��������һ���ü�Һ���ն����������
�ʴ�Ϊ��MnO2+4HCl��Ũ��
��MnCl2+Cl2��+2H2O�����ն�����������ֹβ��������
��Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol?L-1��0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol?L-1��0.2L 0.3mol
Fe+2HCl=FeCl2 +H2��
0.3mol 3.0mol?L-1��0.2L 0.3mol
������Fe�۵����ʵ���Ϊ0.7mol������FeCl2�����ʵ���Ϊ 0.9mol��ԭ��Һ�к���FeCl2=3.0mol?L-1��0.2L=0.6mol
Fe�۵�����Ϊ0.7mol��56g/mol=39.2g��
Cl2+2FeCl2 =2FeCl3
0.75mol 1.5mol
�ʴ�Ϊ��39.2��0.75��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Cu2++Fe=Fe2++Cu��2H++Fe=Fe2++H2����
��һ����KSCN��Һ�����������ӣ�ʵ�����Ϊȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+�����˲���ʹ�õ��ձ���©������������
�ʴ�Ϊ��ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ���ɫ����֤��ԭ��Һ�к���Fe3+��©����
����ͭ���л������ۣ������������ȥ���ۣ��ʴ�Ϊ��HCl��
��2����ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ���������������ݵ����ɡ�ˮ�����γɡ�Һ��������ȣ����ж�װ�������ԣ��ʴ�Ϊ���رշ�Һ©�������������ܲ���ˮ�У�����������ƿ�����ܿ�������ð�����ɿ��ֵ����ڳ���һ��ˮ����֤�����������ã�
��Ũ������������̷�Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��
| ||
�ʴ�Ϊ��MnO2+4HCl��Ũ��
| ||
��Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol?L-1��0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol?L-1��0.2L 0.3mol
Fe+2HCl=FeCl2 +H2��
0.3mol 3.0mol?L-1��0.2L 0.3mol
������Fe�۵����ʵ���Ϊ0.7mol������FeCl2�����ʵ���Ϊ 0.9mol��ԭ��Һ�к���FeCl2=3.0mol?L-1��0.2L=0.6mol
Fe�۵�����Ϊ0.7mol��56g/mol=39.2g��
Cl2+2FeCl2 =2FeCl3
0.75mol 1.5mol
�ʴ�Ϊ��39.2��0.75��
������������Ҫ��������������������ʣ���ʵ�����ʽ��������ķ��롢�ᴿ��ע�ⷢ���Ļ�ѧ��Ӧ��Ԫ���غ�ĽǶ��������ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ