摘要:19.在t cI二时.向容积为2L的密闭容器甲中加入1mol A气体.3mol B气体及少量 固体催化剂.发生下列反应:A,△H <0.10min后各物质的浓度不再变化.测得气体C的体积分数为25%.请填空: (1)计算该反应在0-10min时间内.B的平均反应速率为= .A的转化率为= . (2)在T1℃时.若起始在容器甲中只加人1.0 mol C.则达到平衡时c的体积分数 . a.大于25% b.等于25% c.小于25% (3)右图分别表示的是在T1℃和T2℃时.密闭容器甲中气B的 体积分数随时间变化的曲线.试判断T1 T2 (填“> .“< 或“= ).理由是 . (4)若保持t℃.在体积也为2L的密闭容器乙中通人一定量的 A.B.C三种气体.欲使平衡时容器乙中各物质的物质的 量与容器甲中完全相同.且起始时反应向正反应方向进行. 则通入B的物质的量x的取值范围是 .
网址:http://m.1010jiajiao.com/timu3_id_423697[举报]
已知:在某温度下,存在可逆反应X(g)+Y(g)?2Z(g).在该温度下,向容积为2L的恒容密闭容器中加入2mol X和2mol Y,在1min时达到平衡,混合气体中Z的体积分数[Χ(Z)]随时间(t)变化曲线如图所示,在2min时再向此容器中加入2mol Z,在3min时反应重新达到平衡至4min.
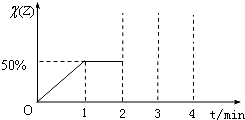
求:(1)该反应在前1min内用X表示的平均速率.
(2)该温度下的平衡常数.
(3)请在图中将0~4min的变化曲线图补充完整.(必须注明图中纵坐标的对应数值) 查看习题详情和答案>>

求:(1)该反应在前1min内用X表示的平均速率.
(2)该温度下的平衡常数.
(3)请在图中将0~4min的变化曲线图补充完整.(必须注明图中纵坐标的对应数值) 查看习题详情和答案>>
已知某温度下,存在可逆反应A(g)+B(g) 2C(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol A和2 mol B,在1min时达到平衡,混合气体中C的体积分数[x(C)]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol C,在3min时反应重新达到平衡至4min。求:
2C(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol A和2 mol B,在1min时达到平衡,混合气体中C的体积分数[x(C)]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol C,在3min时反应重新达到平衡至4min。求:
(1)该反应在前1min达平衡时A的转化率。
(2)该温度下的平衡常数。
(3)请在下图中将0~4min的变化曲线图补充完整(必须注明图中纵坐标的对应数值)。
 2C(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol A和2 mol B,在1min时达到平衡,混合气体中C的体积分数[x(C)]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol C,在3min时反应重新达到平衡至4min。求:
2C(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol A和2 mol B,在1min时达到平衡,混合气体中C的体积分数[x(C)]随时间(t)变化曲线如下图所示,在2min时再向此容器中加入2 mol C,在3min时反应重新达到平衡至4min。求:(1)该反应在前1min达平衡时A的转化率。
(2)该温度下的平衡常数。
(3)请在下图中将0~4min的变化曲线图补充完整(必须注明图中纵坐标的对应数值)。

在某温度下,向容积为2L的密闭反应器中充入0.10mol AB2和一定量的B2发生反应:2AB2(g)+B2(g)?2AB3(g),当反应器中的气体压强不再变化时测得AB2的转化率为80%.已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为( )
查看习题详情和答案>>
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )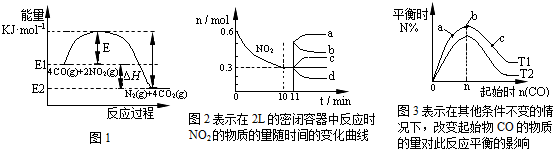

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.
哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.| 时间/min | C(H2)/mol.L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
CO2+3H2 CH3OH+H2O
CH3OH+H2O
 CH3OH+H2O
CH3OH+H2OCO2+3H2 CH3OH+H2O
CH3OH+H2O
.若达平衡状态时,放出的热量为58.8kJ,则上述反应的△H= CH3OH+H2O
CH3OH+H2O-49kJ/mol
-49kJ/mol
.0~10min内,CH3OH的平均反应速率v(CH3OH)=0.012mol/(L?min)
0.012mol/(L?min)
.(2)下列措施能使平衡体系中
| c(CH3OH) |
| c(CO2) |
CD
CD
(填字母).A、升高温度 B、充入Ar使压强增大
C、再充入0.5a mol CO2和0.5a mol H2D、将水从平衡体系中分离出来
(3)a=
4.0mol
4.0mol
,该温度下上述反应的平衡常数K=803.6
803.6
(精确到0.1).(4)在如图所示的坐标系中,画出CO2和H2的浓度随时间变化的图象.