摘要:7.短周期元素a.b.c.d.e.f.g.h的原子序数依次增大.其中a和e.c和g.d和h同主族.b元素的最高正价和最低负价的绝对值之差为2,lmole单质能与冷水反应.在标准状况下生成11.2LH2,f原子最外层电子数等于其周期序数,h.的电子层结构与Ar原子相同. (1)f原子结构示意图为 ,d和e形成的化合物电子式为 -, (2)c和f简单离子的半径大小为 ,(用离子符号和`.’.“=’’或“<.’ 表示) (3)元素非金属性强弱比较有很多方法.其中d和h的非金属性强弱的研究方案 中不可行的是 , ①比较两种单质的颜色 ②比较气态氢化物的稳定性 ③比较与毗反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性 (4)下图是上述部分元素形成的化合物的转化关系图.已知B和D都是具有刺激 性气味的气体.B是形成酸雨的污染物之一 . 请按要求填空: ①化合物A的化学式 ---. ②写出②反应的化学方程式 .
网址:http://m.1010jiajiao.com/timu3_id_419185[举报]
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价.
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式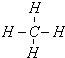
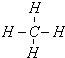
(3)B的氢化物和E的氢化物反应所得生成物的电子式为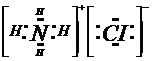
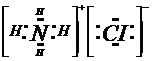 .
.
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
查看习题详情和答案>>
(1)写出E元素在周期表中的位置
第三周期第VIIA族
第三周期第VIIA族
(2)写出A元素气态氢化物的结构式
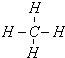
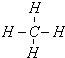
(3)B的氢化物和E的氢化物反应所得生成物的电子式为
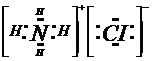
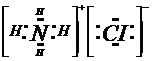
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.(1)E在元素周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
(2)由A、C、F三种元素按原子个数比、1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式
3HClO+2NH3=3HCl+N2+3H2O
3HClO+2NH3=3HCl+N2+3H2O
.(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
| c(H+)甲 | c(H+)乙 |
10-4
10-4
;乙溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)用如图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
,溶液中出现的现象是产生气泡,有白色沉淀生成
产生气泡,有白色沉淀生成
.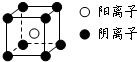 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:(1)BD2的结构式为
O=C=O
O=C=O
,F的离子结构示意图为

三角锥型
三角锥型
.(2)废旧印刷电路板上含有铜,以往回收的方法是将其灼烧使用铜转化为氧化铜,再用稀硫酸来溶解.现改用A2D2和稀硫酸浸泡即达目的,又保护了环境,其反应的化学方程式为
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
;(3)在火箭推进器中装有强还原剂C2A4和强氧化剂A2D2,已知0.5mol液态C2A4和足量液态A2D2反应,生成一种无色无味无毒的气体和水蒸气,放出320kJ热量,写出该反应的热化学方程式
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1
.(4)离子化合物CA5的电子式为


| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)E的简单离子的结构示意图为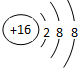
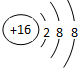 ;
;
(2)D在周期表中的位置为
(3)B和C简单离子的半径大小为
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
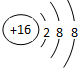
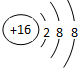
(2)D在周期表中的位置为
第三周期IIIA族
第三周期IIIA族
;(3)B和C简单离子的半径大小为
O2->Na+
O2->Na+
;(用离子符号和“>”、“=”或“<”表示)(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
ad
ad
(填序号);a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
Na2O、Al2O3
Na2O、Al2O3
(写化学式,下同),既含离子键又含共价键的是Na2O2
Na2O2
.短周期元素A、B、C、D、E、F的原子序数依次增大.其中A和E、D和F分别位于同一主族,且B的最外层电子数是次外层电子数的2倍,D是地壳中含量最高的元素;化合物X、Y分别由A与C、A与D组成,且X、Y两种分子中均含有10个电子.
请回答下列问题:
(1)元素C在周期表中的位置是第
(2)Y的电子式为
 .
.
(3)比较F和E形成简单离子的半径大小:
(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
(5)X的空间构型为
查看习题详情和答案>>
请回答下列问题:
(1)元素C在周期表中的位置是第
二
二
周期ⅤA
ⅤA
族.(2)Y的电子式为


(3)比较F和E形成简单离子的半径大小:
S2->Na+
S2->Na+
(填离子符号).(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
H2+2OH-+2e-=2H2O
H2+2OH-+2e-=2H2O
.(5)X的空间构型为
三角锥
三角锥
,工业上生产X的反应中,若每生成a mol X时放出b kJ热量,则该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-
kJ/mol
| 2b |
| a |
N2(g)+3H2(g)=2NH3(g)△H=-
kJ/mol
.| 2b |
| a |