题目内容
 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:(1)BD2的结构式为
O=C=O
O=C=O
,F的离子结构示意图为

三角锥型
三角锥型
.(2)废旧印刷电路板上含有铜,以往回收的方法是将其灼烧使用铜转化为氧化铜,再用稀硫酸来溶解.现改用A2D2和稀硫酸浸泡即达目的,又保护了环境,其反应的化学方程式为
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
;(3)在火箭推进器中装有强还原剂C2A4和强氧化剂A2D2,已知0.5mol液态C2A4和足量液态A2D2反应,生成一种无色无味无毒的气体和水蒸气,放出320kJ热量,写出该反应的热化学方程式
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1
.(4)离子化合物CA5的电子式为


| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
分析:根据题意知,F的单质在D2中燃烧的产物可使品红溶液褪色,能使品红溶液褪色的化合物是二氧化硫,所以F是硫,D单质是氧气;E的单质与氧气反应可生成E2D和E2D2两种固体,E在化合物中的化合价是+1价,E2D2中氧元素的化合价是-1价,所以E是钠;A与E同主族,且A的原子序数最小,CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等,所以A是氢元素;B的单质在氧气中燃烧可生成BD和BD2两种气体,A、B、C、D、E、F原子序数依次增大,所以B是碳元素,C是氮元素,所以A、B、C、D、E、F分别是氢元素、碳元素、氮元素、氧元素、钠元素、硫元素.
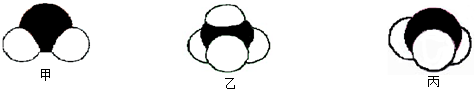
(1)根据二氧化碳的结构写出结构式;根据硫离子的核外电子写出其离子结构示意图;根据氨气分子的VSEPR模型判断其空间构型;
(2)根据氧化铜和稀硫酸反应的生成物写出双氧水和铜、硫酸反应的方程式;
(3)根据反应物和生成物及焓变之间的关系写出热化学反应方程式;
(4)先判断该离子化合物的化学式,再根据其化学式写出电子式;
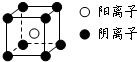
设晶胞的边长为acm,则有
=d,a=
,晶体中阴离子与阳离子之间的最短距离为顶点和体心的距离,为
a=
.
(1)根据二氧化碳的结构写出结构式;根据硫离子的核外电子写出其离子结构示意图;根据氨气分子的VSEPR模型判断其空间构型;
(2)根据氧化铜和稀硫酸反应的生成物写出双氧水和铜、硫酸反应的方程式;
(3)根据反应物和生成物及焓变之间的关系写出热化学反应方程式;
(4)先判断该离子化合物的化学式,再根据其化学式写出电子式;
设晶胞的边长为acm,则有
| ||
| a3 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
解答:解:(1)二氧化碳中碳元素和氧元素形成的是共价键,是直线型结构,碳和一个氧原子之间存在两对共用电子对,所以其结构式为O=C=O;硫离子中含有18个电子,所以其离子结构示意图为 ,氨气是三角锥型结构,
,氨气是三角锥型结构,
故答案为:O=C=O; ;三角锥型;
;三角锥型;
(2)氧化铜和稀硫酸反应的生成物是硫酸铜和水,双氧水有强氧化性,铜有还原性,在酸性条件下,双氧水和铜能发生氧化还原反应,所以双氧水和铜、稀硫酸的反应方程式为:
Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(3)0.5molN2H4参加反应放出320KJ能量,所以1molN2H4参加反应放出640kJ能量,所以该热化学反应方程式为:
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1,
故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1;
(4)离子化合物CA5为NH4H,所以阴离子为氢离子,阳离子为铵根离子,其电子式为 ;
;
晶胞中含有的阳离子个数为1,阴离子个数为8×
=1,即晶胞中含有一个“NH4H分子”,设晶胞的边长为acm,则有
=d,a=
,晶体中阴离子与阳离子之间的最短距离为顶点和体心的距离,为
a=
,
故答案为: ;
;
.
 ,氨气是三角锥型结构,
,氨气是三角锥型结构,故答案为:O=C=O;
 ;三角锥型;
;三角锥型;(2)氧化铜和稀硫酸反应的生成物是硫酸铜和水,双氧水有强氧化性,铜有还原性,在酸性条件下,双氧水和铜能发生氧化还原反应,所以双氧水和铜、稀硫酸的反应方程式为:
Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(3)0.5molN2H4参加反应放出320KJ能量,所以1molN2H4参加反应放出640kJ能量,所以该热化学反应方程式为:
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1,
故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1;
(4)离子化合物CA5为NH4H,所以阴离子为氢离子,阳离子为铵根离子,其电子式为
 ;
;晶胞中含有的阳离子个数为1,阴离子个数为8×
| 1 |
| 8 |
| ||
| a3 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
故答案为:
 ;
;
| ||
| 2 |
| 3 |
| ||
点评:本题考查较为综合,涉及原子结构与元素周期律知识以及晶胞的计算等知识,题目难度较大,注意利用均摊法判断晶胞问题.

练习册系列答案
相关题目