网址:http://m.1010jiajiao.com/timu3_id_41670[举报]
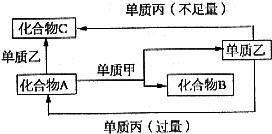 A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属因态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是______;B的电子式是______;A与甲反应的化学方程式是______.
(2)若甲在转化中为氧化剂,是常见的非金属气态单质,丙是常见金属,甲、乙、丙中只有甲由短周期元素组成,乙与甲同主族,与丙同周期,乙也有强氧化性,通常条件下都在溶液中进行反应,则:
①A与乙反应的离子方程式为:______
②C与丙反应的离子方程式为:______
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合图1所示的转化关系,则反应的离子方程式为:______.
查看习题详情和答案>>
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C元素在元素周期表中的位置是
(2)C和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(4)F含有的化学键类型是 ,其水溶液呈酸性,请用相关的离子方程式解释其原因
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为
查看习题详情和答案>>A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
(1)C元素在元素周期表中的位置是________
(2)C和E两种元素相比较,非金属性较强的是(填元素名称)________,可以验证该结论的是(填写编号)________;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为________;
(4)F含有的化学键类型是________,其水溶液呈酸性,请用相关的离子方程式解释其原因________
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为________
(13分)已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
⑴写出反应②的化学方程式 。
⑵反应④中每消耗1 mol G,转移电子的物质的量为 。
⑶反应⑥的离子方程式是 。
⑷写出工业冶炼金属乙的化学方程式 。
⑸实验室中保存I的方法是 。
⑹SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混入O2,可能引起的后果是 。
查看习题详情和答案>>
(13分)已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):

⑴写出反应②的化学方程式 。
⑵反应④中每消耗1 mol G,转移电子的物质的量为 。
⑶反应⑥的离子方程式是 。
⑷写出工业冶炼金属乙的化学方程式 。
⑸实验室中保存I的方法是 。
⑹SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混入O2,可能引起的后果是 。
查看习题详情和答案>>