题目内容
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
(1)C元素在元素周期表中的位置是________
(2)C和E两种元素相比较,非金属性较强的是(填元素名称)________,可以验证该结论的是(填写编号)________;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为________;
(4)F含有的化学键类型是________,其水溶液呈酸性,请用相关的离子方程式解释其原因________
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为________
答案:
解析:
解析:
|
(1)第2周期ⅥA (2)氧 bc (3)HS-+OH-=H2O+S2- (4)离子键和共价键;NH4++H2O (5)2Na2O2+2H2O=4NaOH+O2 |

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目



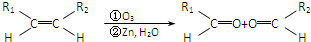

 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )