摘要:30.右图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分.图上标有ⅥA族和几种元素的位置.请回答下列问题: (1)请写出g元素在周期表中的位置 .并将铁的元素符号填在上图中合适的位置. (2)下列叙述正确的是 . A.氢化物Hd比Hh稳定.H2f的沸点高于H2O B.离子半径r C.化合物bh4与bf2均为非极性分子 D.由图中标出的8种元素形成的10e-结构的阳离子只有Na+和 (3)已知由元素a.b.w组成的化合物abw可称为“氢某酸 .分子中各原子均达到稳定状态.试写出其电子式 ,又知此酸对应的钾盐有剧毒.常温下其钾盐溶液的pH=9.则其溶液中由水电离出的c(OH-)= mol/L.该溶液中所有离子的浓度由大到小的顺序是 . (4)元素e的某化合物固体呈淡黄色.该物质与e2f的溶液反应生成淡黄色沉淀.则反应的离子方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_409395[举报]
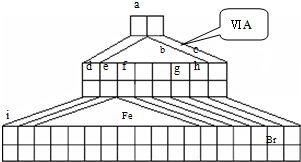
I.如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
(2)Fe的周期位置
(3)用电子式表示元素a、g形成化合物的形成过程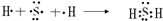
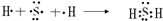 ;
;
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式
(6)a元素与碳元素形成分子的空间结构可能是(填序号)

(7)请设计实验比较e f 的金属性强弱(要求有操作、现象、结论)
(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
查看习题详情和答案>>

(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
Na+[:H]-
Na+[:H]-
.(2)Fe的周期位置
第四周期第VIII族
第四周期第VIII族
(3)用电子式表示元素a、g形成化合物的形成过程
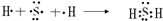
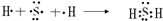
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式
NH3+HNO3═NH4NO3
NH3+HNO3═NH4NO3
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(6)a元素与碳元素形成分子的空间结构可能是(填序号)
cd
cd
.
(7)请设计实验比较e f 的金属性强弱(要求有操作、现象、结论)
取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱
取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱
.(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-
3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-
.肉桂酸甲酯是一种常用的调制具有水果香味的食用香精.右图是由A(苯乙烯)合成肉桂酸甲酯H等有机物的合成信息:
已知:①
②F为含有三个六元环的酯;

请回答下列问题:
(1)D→G的反应类型是
(2)D转化为G的化学方程式是
 ;
;
(3)D转化为E的化学方程式是
 ;
;
(4)F的结构简式是
 ;
;
(5)写出符合以下条件的D的全部同分异构体的结构简式 、
、
 、
、 .
.
①结构通式可表示为: (其中X、Y均不为H);
(其中X、Y均不为H);
②能发生银镜反应;
③遇FeCl3溶液呈紫色.
查看习题详情和答案>>
已知:①

②F为含有三个六元环的酯;

请回答下列问题:
(1)D→G的反应类型是
消去反应
消去反应
;G→H的反应类型是酯化反应(或取代反应)
酯化反应(或取代反应)
;(2)D转化为G的化学方程式是


(3)D转化为E的化学方程式是


(4)F的结构简式是


(5)写出符合以下条件的D的全部同分异构体的结构简式
 、
、
 、
、
①结构通式可表示为:
 (其中X、Y均不为H);
(其中X、Y均不为H);②能发生银镜反应;
③遇FeCl3溶液呈紫色.
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
(4)下列叙述正确的是
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是
第4周期第Ⅷ族
第4周期第Ⅷ族
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
Na+[:H]-
Na+[:H]-
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
促进
促进
(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)下列叙述正确的是
A、D、E
A、D、E
.A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
.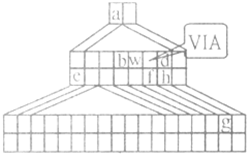 如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置.请回答下列问题:
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置.请回答下列问题:(1)g元素在周期表中的位置
(2)d的氢化物的沸点比h的氢化物的沸点
(3)用电子式表示化合物eh的形成过程
(4)b和w可形成一种原子晶体,它的用途有
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>