题目内容
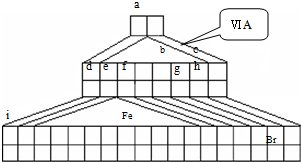
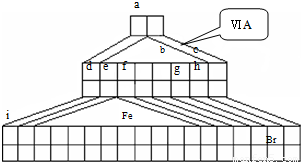
I.如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
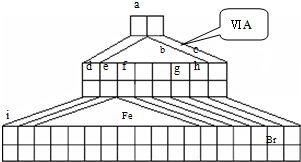
(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
(2)Fe的周期位置
(3)用电子式表示元素a、g形成化合物的形成过程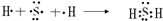
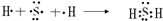 ;
;
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式
(6)a元素与碳元素形成分子的空间结构可能是(填序号)

(7)请设计实验比较e f 的金属性强弱(要求有操作、现象、结论)
(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为

(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
Na+[:H]-
Na+[:H]-
.(2)Fe的周期位置
第四周期第VIII族
第四周期第VIII族
(3)用电子式表示元素a、g形成化合物的形成过程
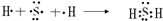
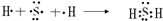
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式
NH3+HNO3═NH4NO3
NH3+HNO3═NH4NO3
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(6)a元素与碳元素形成分子的空间结构可能是(填序号)
cd
cd
.
(7)请设计实验比较e f 的金属性强弱(要求有操作、现象、结论)
取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱
取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱
.(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-
3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-
.分析:(1)第ⅦA族的元素的最低化合价为-1价,则NaH为离子化合物;
(2)根据图可知铁元素在第四周期,在周期表中的第8列来分析;
(3)硫化氢是由硫原子和氢原子间通过共用电子对形成的共价化合物;
(4)由周期表可知,b为N元素,b元素的氢化物与其最高价氧化物的水化物可生成一种盐为硝酸铵;
(5)金属铝能和强碱反应生成盐、氢气;
(6)碳原子和氢原子之间形成的化合物有烷烃和芳香烃等;
(7)比较金属活泼性强弱的方法之一:和酸反应生成氢气的难易;
(8)过氧化钠具有氧化性,能将亚铁离子氧化为三价铁,利用氧化还原反应来分析.
(2)根据图可知铁元素在第四周期,在周期表中的第8列来分析;
(3)硫化氢是由硫原子和氢原子间通过共用电子对形成的共价化合物;
(4)由周期表可知,b为N元素,b元素的氢化物与其最高价氧化物的水化物可生成一种盐为硝酸铵;
(5)金属铝能和强碱反应生成盐、氢气;
(6)碳原子和氢原子之间形成的化合物有烷烃和芳香烃等;
(7)比较金属活泼性强弱的方法之一:和酸反应生成氢气的难易;
(8)过氧化钠具有氧化性,能将亚铁离子氧化为三价铁,利用氧化还原反应来分析.
解答:解:(1)把H放在第ⅦA族,则H元素的最低化合价为-1价,则NaH为离子化合物,电子式为Na+[:H]-,故答案为:Na+[:H]-;
(2)铁元素在第四周期,在周期表中的第8列,即第四周期第VIII族,故答案为:第四周期第VIII族;
(3)硫化氢是由硫原子和氢原子间通过共用电子对形成的共价化合物,其形成过程表示为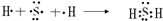 ,故答案为:
,故答案为: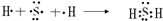 ;
;
(4)由周期表可知,b为N元素,b元素的氢化物氨气与其最高价氧化物的水化物硝酸可生成一种盐为硝酸铵,即NH3+HNO3═NH4NO3,故答案为:NH3+HNO3═NH4NO3;
(5)d的最高价氧化物氢氧化钠和f的单质铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碳原子和氢原子之间形成的化合物甲烷是正四面体结构,苯是平面六边形结构,故答案为:cd;
(7)比较镁和铝金属活泼性强弱的方法:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱,故答案为:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱;
(8)d为钠,d的某化合物呈淡黄色,则该化合物为过氧化钠,具有氧化性,沉淀和气体的物质的量之比为2:1,发生的反应为3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-,
故答案为:3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-.
(2)铁元素在第四周期,在周期表中的第8列,即第四周期第VIII族,故答案为:第四周期第VIII族;
(3)硫化氢是由硫原子和氢原子间通过共用电子对形成的共价化合物,其形成过程表示为
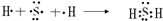 ,故答案为:
,故答案为: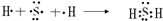 ;
;(4)由周期表可知,b为N元素,b元素的氢化物氨气与其最高价氧化物的水化物硝酸可生成一种盐为硝酸铵,即NH3+HNO3═NH4NO3,故答案为:NH3+HNO3═NH4NO3;
(5)d的最高价氧化物氢氧化钠和f的单质铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碳原子和氢原子之间形成的化合物甲烷是正四面体结构,苯是平面六边形结构,故答案为:cd;
(7)比较镁和铝金属活泼性强弱的方法:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱,故答案为:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱;
(8)d为钠,d的某化合物呈淡黄色,则该化合物为过氧化钠,具有氧化性,沉淀和气体的物质的量之比为2:1,发生的反应为3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-,
故答案为:3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-.
点评:本题考查学生利用元素周期表和周期律解答,明确元素的位置判断元素是解答的突破,并利用非金属性的比较、盐类水解、氧化还原反应等知识来解答即可,难度较大.

练习册系列答案
相关题目