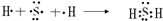题目内容
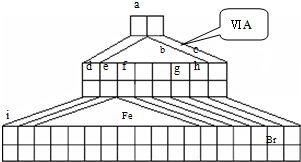
 如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置.请回答下列问题:
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置.请回答下列问题:(1)g元素在周期表中的位置
(2)d的氢化物的沸点比h的氢化物的沸点
(3)用电子式表示化合物eh的形成过程
(4)b和w可形成一种原子晶体,它的用途有
分析:由元素在周期表中的位置可知,a为H、b为C、w为N、d为F、e为Na、f为O、h为Cl、g为Br,
(1)由g在周期表中的位置可知,其处于第四周期ⅦA族;wa3是NH3,为三角锥型,根据正负电荷重心是否重合判断分子极性;
(2)根据HF分之间存在氢键解答;
(3)NaCl是离子化合物,左边为原子电子式,右边为NaCl电子式,中间用“→”连接,注意离子化合物阴离子带电荷且用“[]”;
(4)根据原子守恒可知C、N形成的原子晶体为C3N4,其熔点高、硬度大,性质决定其用途.
(1)由g在周期表中的位置可知,其处于第四周期ⅦA族;wa3是NH3,为三角锥型,根据正负电荷重心是否重合判断分子极性;
(2)根据HF分之间存在氢键解答;
(3)NaCl是离子化合物,左边为原子电子式,右边为NaCl电子式,中间用“→”连接,注意离子化合物阴离子带电荷且用“[]”;
(4)根据原子守恒可知C、N形成的原子晶体为C3N4,其熔点高、硬度大,性质决定其用途.
解答:解:由元素在周期表中的位置可知,a为H、b为C、w为N、d为F、e为Na、f为O、h为Cl、g为Br,
(1)由g在周期表中的位置可知,其处于第四周期ⅦA族;wa3是NH3,为三角锥型,分子中正负电荷重心不重合,为极性分子,故答案为:第四周期ⅦA族;极性;
(2)HF、HCl均为分子晶体,HF分子之间存在氢键,且氢键强于分子间作用力,故HF的沸点较高,
故答案为:高;HF、HCl均为分子晶体,HF分子之间存在氢键,且氢键强于分子间作用力;
根据HF分之间存在氢键解答;
(3)NaCl是离子化合物,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(4)C、N形成的原子晶体,其熔点高、硬度大,可以用作高温结构陶瓷材料、作轴承、气轮机叶片、机械密封环,永久性模具等机械构件,由化合物C(NH2)4在高温下分解可生成NH3和该原子晶体,根据原子守恒可知C、N形成的原子晶体为C3N4,
故答案为:作高温结构陶瓷材料、作轴承、气轮机叶片、机械密封环,永久性模具等机械构件;C3N4.
(1)由g在周期表中的位置可知,其处于第四周期ⅦA族;wa3是NH3,为三角锥型,分子中正负电荷重心不重合,为极性分子,故答案为:第四周期ⅦA族;极性;
(2)HF、HCl均为分子晶体,HF分子之间存在氢键,且氢键强于分子间作用力,故HF的沸点较高,
故答案为:高;HF、HCl均为分子晶体,HF分子之间存在氢键,且氢键强于分子间作用力;
根据HF分之间存在氢键解答;
(3)NaCl是离子化合物,用电子式表示其形成过程为:
 ,
,故答案为:
 ;
;(4)C、N形成的原子晶体,其熔点高、硬度大,可以用作高温结构陶瓷材料、作轴承、气轮机叶片、机械密封环,永久性模具等机械构件,由化合物C(NH2)4在高温下分解可生成NH3和该原子晶体,根据原子守恒可知C、N形成的原子晶体为C3N4,
故答案为:作高温结构陶瓷材料、作轴承、气轮机叶片、机械密封环,永久性模具等机械构件;C3N4.
点评:本题考查元素周期表和周期律综合应用,涉及分子结构与性质、常用化学用语、氢键、晶体类型与性质等,难度不大,侧重对基础知识的巩固.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目

 NH3?H2O+H+
NH3?H2O+H+