摘要: (1)恒温下.向pH=6的蒸馏水中加入2.3g金属钠.充分反应后.再加蒸馏水稀释到1L.所得溶液的pH= . (2)向pH=6的蒸馏水和c(H+)=10-6mol·L-1的稀盐酸中分别投入大小.质量相同的金属钠.反应刚开始时.产生H2的速率前者与后者相比是 . A.一样快 B.前者快 C.后者快 D.无法比较 (3)用惰性电极电解NaCl与NaHCO3混合溶液.测得溶液pH变化如下图所示. ① 在0→t时间内.两个电极上的电极反应式为: 阳极 ,阴极 . ②用离子方程式表明0→t时间内.溶液pH升高比较缓慢的原因: .
网址:http://m.1010jiajiao.com/timu3_id_409253[举报]
 (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=11
11
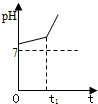
.(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如图所示.
①在0→t1时间内,两个电极上的电极反应式为:阳极
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
;阴极2H++2e-═H2↑
2H++2e-═H2↑
.②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:
OH-+HCO3-═H2O+CO32-
OH-+HCO3-═H2O+CO32-
.
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=______.
(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如图所示.
①在0→t1时间内,两个电极上的电极反应式为:阳极______;阴极______.
②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:______.
 查看习题详情和答案>>
查看习题详情和答案>>
(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如图所示.
①在0→t1时间内,两个电极上的电极反应式为:阳极______;阴极______.
②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:______.
 查看习题详情和答案>>
查看习题详情和答案>>
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中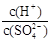 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中
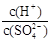 的比值为
的比值为 (3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中
 的平衡浓度,c(
的平衡浓度,c( )平=
)平=