题目内容
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中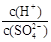 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中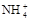 的平衡浓度,c(
的平衡浓度,c(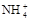 )平=
)平=
(1) 11 (2) 20 (3) 1:10:1010:109 (4) (每空3分)
(每空3分)
解析

练习册系列答案
相关题目
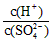 的比值为_______________。
的比值为_______________。 )、c(H+)及氨水的Kb值、水的Kw值表示该溶液中的平衡浓度,c(
)、c(H+)及氨水的Kb值、水的Kw值表示该溶液中的平衡浓度,c( )平 =___________________。
)平 =___________________。