题目内容
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中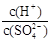 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中
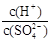 的比值为
的比值为 (3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中
 的平衡浓度,c(
的平衡浓度,c( )平=
)平= (1) 11 (2) 20 (3) 1:10:1010:109 (4)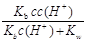 (每空3分)
(每空3分)
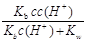 (每空3分)
(每空3分)(1)反应方程式:2Na+2H2O==2NaOH+H2;加入0.1mol钠,可生成0.1molNaOH;
因此NaOH物质的量浓度为0.1mol/L,OH-浓度为0.1mol/L;由题干可得该温度下水的离子积常数为10 -12,因此pOH=1;pH="12-pOH=11"
(2) pH=5的H2SO4溶液稀释1000倍后,硫酸电离的H+浓度确实应该是10-8,但此时水本身的电离就不能忽视了,因为水本身电离出的氢离子浓度超过了硫酸电离的氢离子,此时溶液是酸性接近中性。原溶液中硫酸根的浓度是5×10-6,稀释1000被变成了5×10-9。所以H+与SO42-的比为1×10-7:5×10-9=20:1
(3) 在不同的溶液中水的电离被抑制或被促进,其计算公式如下:①酸溶液中,溶液中的c(OH-)液为水电离出的c(OH-)水,所以c(H+)水=c(OH-)液=KWc(H+)液;②碱溶液中,溶液中的c(H+)液为水电离出的c(H+)水,所以c(OH-)水=c(H+)液=KWc(OH-)液;③强酸弱碱盐溶液中的c(H+)液为水电离出的c(H+)水,所以c(H+)水=c(H+)液;④强碱弱酸盐溶液中的c(OH-)液为水电离出的c(OH-)水,所以c(OH-)水=c(OH-)液。由以上公式易确定本题的答案1:10:1010:109
(4)根据氨水的电离平衡、水的电离平衡、中和方程式即可解得c( )平=
)平=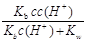
因此NaOH物质的量浓度为0.1mol/L,OH-浓度为0.1mol/L;由题干可得该温度下水的离子积常数为10 -12,因此pOH=1;pH="12-pOH=11"
(2) pH=5的H2SO4溶液稀释1000倍后,硫酸电离的H+浓度确实应该是10-8,但此时水本身的电离就不能忽视了,因为水本身电离出的氢离子浓度超过了硫酸电离的氢离子,此时溶液是酸性接近中性。原溶液中硫酸根的浓度是5×10-6,稀释1000被变成了5×10-9。所以H+与SO42-的比为1×10-7:5×10-9=20:1
(3) 在不同的溶液中水的电离被抑制或被促进,其计算公式如下:①酸溶液中,溶液中的c(OH-)液为水电离出的c(OH-)水,所以c(H+)水=c(OH-)液=KWc(H+)液;②碱溶液中,溶液中的c(H+)液为水电离出的c(H+)水,所以c(OH-)水=c(H+)液=KWc(OH-)液;③强酸弱碱盐溶液中的c(H+)液为水电离出的c(H+)水,所以c(H+)水=c(H+)液;④强碱弱酸盐溶液中的c(OH-)液为水电离出的c(OH-)水,所以c(OH-)水=c(OH-)液。由以上公式易确定本题的答案1:10:1010:109
(4)根据氨水的电离平衡、水的电离平衡、中和方程式即可解得c(
 )平=
)平=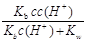

练习册系列答案
相关题目
 c(HCO3-)
c(HCO3-) c(CO32-)
c(CO32-)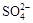 、K+
、K+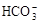 、Na+
、Na+ 、Cl-、K+
、Cl-、K+