题目内容
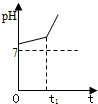
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=______.(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如图所示.
①在0→t1时间内,两个电极上的电极反应式为:阳极______;阴极______.
②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:______.

【答案】分析:(1)先计算溶液中氢氧化钠的物质的量浓度,再计算溶液的pH;
(2)用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,当氯离子完全析出后,发生第二段电解,第二段电解:相当于电解碳酸氢钠和碳酸钠的混合液,阳极上氢氧根离子放电,阴极上氢离子放电,实际上相当于电解水.
解答:解:(1)恒温下,pH=6的蒸馏水中KW=c(H+)=c(OH-)=(10-6)2=10-12,2.3g金属钠的物质的量= ,c(OH-)=c(NaOH)=
,c(OH-)=c(NaOH)= =0.1mol/L,c(H+)=
=0.1mol/L,c(H+)=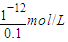 =10-11mol/L,所以溶液的pH=11,故答案为:11;
=10-11mol/L,所以溶液的pH=11,故答案为:11;
(2)①用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑,故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
②用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,故答案为:OH-+HCO3-═H2O+CO32-.
点评:本题考查电解原理,明确该温度下水的离子积常数是解本题关键,会分析图象中出现拐点的原因.
(2)用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,当氯离子完全析出后,发生第二段电解,第二段电解:相当于电解碳酸氢钠和碳酸钠的混合液,阳极上氢氧根离子放电,阴极上氢离子放电,实际上相当于电解水.
解答:解:(1)恒温下,pH=6的蒸馏水中KW=c(H+)=c(OH-)=(10-6)2=10-12,2.3g金属钠的物质的量=
 ,c(OH-)=c(NaOH)=
,c(OH-)=c(NaOH)= =0.1mol/L,c(H+)=
=0.1mol/L,c(H+)=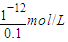 =10-11mol/L,所以溶液的pH=11,故答案为:11;
=10-11mol/L,所以溶液的pH=11,故答案为:11;(2)①用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑,故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
②用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,故答案为:OH-+HCO3-═H2O+CO32-.
点评:本题考查电解原理,明确该温度下水的离子积常数是解本题关键,会分析图象中出现拐点的原因.

练习册系列答案
相关题目
 (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= (2013?潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
(2013?潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示: 的比值为
的比值为  的平衡浓度,c(
的平衡浓度,c( 的比值为_______________。
的比值为_______________。 )、c(H+)及氨水的Kb值、水的Kw值表示该溶液中的平衡浓度,c(
)、c(H+)及氨水的Kb值、水的Kw值表示该溶液中的平衡浓度,c( )平 =___________________。
)平 =___________________。