题目内容
在固定体积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.1,0.2,达到平衡时,浓度可能正确的是( )
| A、SO2为0.4mol/L | B、SO2为0.25mol/L | C、O2为0.2mol/L | D、O2为0mol/L |
分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:解:2SO2(g)+O2(g)  2SO3(g),
2SO3(g),
某时刻0.2mol/L 0.1mol/L 0.2mol/L
极限转化0.4mol/L 0.2mol/L 0
极限转化 0 0 0.4mol/L
SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,实际变化为0.05mol/L,小于0.2mol/L;
由于反应为可逆反应,O2浓度小于0.2mol/L,大于0.故选B.
 2SO3(g),
2SO3(g),某时刻0.2mol/L 0.1mol/L 0.2mol/L
极限转化0.4mol/L 0.2mol/L 0
极限转化 0 0 0.4mol/L
SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,实际变化为0.05mol/L,小于0.2mol/L;
由于反应为可逆反应,O2浓度小于0.2mol/L,大于0.故选B.
点评:本题考查可逆反应,注意可逆反应的特点为不完全转化性,学生应学会利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
在固定体积的密闭容器中进行如下反应:2AB2(g)+B2(g)?2AB3(g).已知反应过程某一时刻AB2、B2、AB3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,达到平衡时,浓度可能正确的是( )
| A、AB2、B2分别为0.4mol/L、0.2mol/L | B、AB2为0.25mol/L | C、AB2、AB3均为0.15mol/L | D、AB3为0.4mol/L |
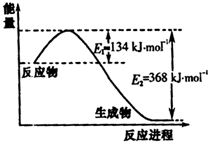
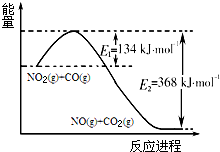 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.