摘要:现有A.B.C.D.E五种短周期元素.其原子序数依次增加.其中元素A.B.C构成的化合物称“烧碱 .D是最重要的半导体材料.它的高纯度单质是制造电脑CPU芯片的主要材料.而E的单质是一种常用于杀菌消毒的气体.有关高纯度D单质的生产流程如下: 试回答下列问题:(1)D元素在周期表中的位置为 ,指出化学式为C2B2 的物质中所含的化学健类型 . . (2)写出反应②的化学方程式 ,预测化合物丙的空间构型 .固态时丙应属于 晶体.指出化合物A2B的沸点高于乙的沸点的主要原因 . (3)已知D单质的结成与金刚石类似.如图所示. 则该晶体中D单质原子数与D-D单健的数目 比为 .该晶胞的边长为n. 摩尔质量为M.阿佛加德罗常数为 NA.则该晶体的密度为 g/cm3(用 代数式表达). 模块 26-28为选择题.每小题只有一个正确选项.每小题3分
网址:http://m.1010jiajiao.com/timu3_id_40177[举报]
现有A、B、C、D、E五种短周期元素,其中元素A、B、C组成的化合物俗称“烧碱”,D是最重要半导体材料,它的高纯度单质是制造电脑CPU芯片的主要材料,而E的单质是一种常用于杀菌消毒的气体.有关高纯度D单质的生产流程如图1所示:
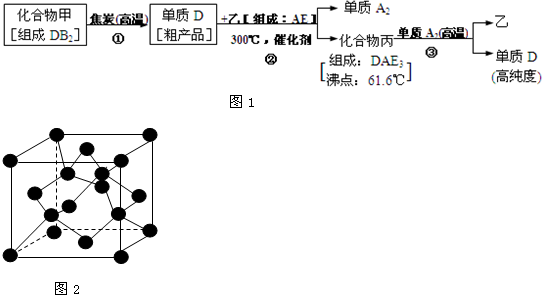
试回答下列问题:
(1)E-的核外电子排布式为 ,C2B2的电子式为 .
(2)电负性:D元素 E元素.(填:“>”、“<”或“=”)
(3)预测D的氢化物的空间构成的空间构型为 ,化合物丙中的D元素原子轨道发生的是 杂化,固态时丙属于 晶体.
(4)化合物A2B的沸点高于化合物乙的沸点的主要原因是 .
(5)已知D单质的结构与金刚石类似,如图2所示.则该晶体中D原子数与D-D单键的数目比为 ,该晶胞的边长为a(单位:cm),D的摩尔质量为M单位:g?mol-1),阿佛加德罗常数为NA,则该晶体的密度为 g?cm-3.(用代数式表达)
查看习题详情和答案>>

试回答下列问题:
(1)E-的核外电子排布式为
(2)电负性:D元素
(3)预测D的氢化物的空间构成的空间构型为
(4)化合物A2B的沸点高于化合物乙的沸点的主要原因是
(5)已知D单质的结构与金刚石类似,如图2所示.则该晶体中D原子数与D-D单键的数目比为
现有A、B、C、D、E五种短周期元素,其中A、B两种元素同主族,A元素原子的最外层电子数是内层电子的数3倍;C是所有元素中原子半径最小的;D的气态氢化物水溶液能使湿润的红色石蕊试纸变蓝;在A、E形成的化合物EA中,A、E离子核外电子数均为10.请按要求回答下列问题:
Ⅰ.(1)写出元素E在元素周期表的位置______;
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是______(填化学式).
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式______高温高压2NH3 查看习题详情和答案>>
Ⅰ.(1)写出元素E在元素周期表的位置______;
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是______(填化学式).
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式______高温高压2NH3 查看习题详情和答案>>
现有A、B、C、D、E五种短周期元素,其中A、B两种元素同主族,A元素原子的最外层电子数是内层电子的数3倍;C是所有元素中原子半径最小的;D的气态氢化物水溶液能使湿润的红色石蕊试纸变蓝;在A、E形成的化合物EA中,A、E离子核外电子数均为10.请按要求回答下列问题:
Ⅰ.(1)写出元素E在元素周期表的位置______;
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是______(填化学式).
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式______;
(2)在一定条件下,将amolC单质和bmolD单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.
查看习题详情和答案>>
Ⅰ.(1)写出元素E在元素周期表的位置______;
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是______(填化学式).
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式______;
(2)在一定条件下,将amolC单质和bmolD单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.
现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A、D同主族C、E 同主族,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子M、N,且N为比较常见的液态化合物.请回答下列问题:
(1)B的简单阴离子的结构示意图
 .
.
(2)A、D、E三种元素组成的化合物电子式为:

(3)①C、D、E对应的简单离子的半径由大到小为
(4)A、C、E三种元素能形成多种18电子分子,写出其中两种所能发生的反应方程式
(5)标况下,1gD单质在C单质中完全燃烧可放出QKJ热量.则此反应的热化学方程式为
查看习题详情和答案>>
(1)B的简单阴离子的结构示意图


(2)A、D、E三种元素组成的化合物电子式为:


(3)①C、D、E对应的简单离子的半径由大到小为
S2->O2->Na+
S2->O2->Na+
(用离子符号表示)②写出能证明C和E非金属性强弱的一个化学方程式2H2S+O2═2H2O+2S
2H2S+O2═2H2O+2S
.(4)A、C、E三种元素能形成多种18电子分子,写出其中两种所能发生的反应方程式
H2O2+H2S=S↓+2H2O
H2O2+H2S=S↓+2H2O
(5)标况下,1gD单质在C单质中完全燃烧可放出QKJ热量.则此反应的热化学方程式为
2Na(s)+O2(g)=Na2O2(s)△H=-46QkJ/mol
2Na(s)+O2(g)=Na2O2(s)△H=-46QkJ/mol
.
现有A、B、C、D、E五种短周期元素,已知:?
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;?
③B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;?
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:?
(1)D2C2的电子式 。?
(2)1 mol E单质与足量乙的溶液反应,能生产 mol A2气体。并写出其反应的离子方程式 。
(3)写出下列溶液反应的离子方程式:?
乙+丙: 。?
(4)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为 。?
(5)以石墨为电极,电解乙的溶液400 mL,当电路中通过a mol电子时,阴、阳两极共产生气体 L(标准状况),溶液中c(OH-) (填“增大”“减小”或“不变”)。?
查看习题详情和答案>>