题目内容
现有A、B、C、D、E五种短周期元素,其中元素A、B、C组成的化合物俗称“烧碱”,D是最重要半导体材料,它的高纯度单质是制造电脑CPU芯片的主要材料,而E的单质是一种常用于杀菌消毒的气体.有关高纯度D单质的生产流程如图1所示:
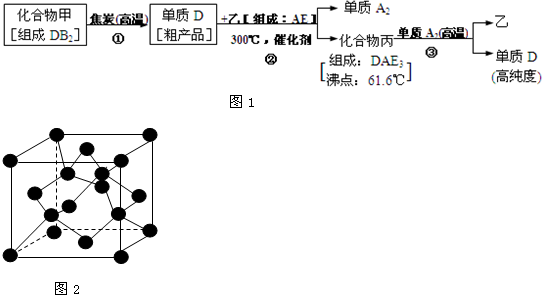
试回答下列问题:
(1)E-的核外电子排布式为 ,C2B2的电子式为 .
(2)电负性:D元素 E元素.(填:“>”、“<”或“=”)
(3)预测D的氢化物的空间构成的空间构型为 ,化合物丙中的D元素原子轨道发生的是 杂化,固态时丙属于 晶体.
(4)化合物A2B的沸点高于化合物乙的沸点的主要原因是 .
(5)已知D单质的结构与金刚石类似,如图2所示.则该晶体中D原子数与D-D单键的数目比为 ,该晶胞的边长为a(单位:cm),D的摩尔质量为M单位:g?mol-1),阿佛加德罗常数为NA,则该晶体的密度为 g?cm-3.(用代数式表达)

试回答下列问题:
(1)E-的核外电子排布式为
(2)电负性:D元素
(3)预测D的氢化物的空间构成的空间构型为
(4)化合物A2B的沸点高于化合物乙的沸点的主要原因是
(5)已知D单质的结构与金刚石类似,如图2所示.则该晶体中D原子数与D-D单键的数目比为
分析:A、B、C、D、E五种短周期元素,其中元素A、B、C组成的化合物俗称“烧碱”,三元素形成化合物为NaOH;D是最重要半导体材料,它的高纯度单质是制造电脑CPU芯片的主要材料,则D为Si;E的单质是一种常用于杀菌消毒的气体,则E为Cl;结合高纯度D单质的生产流程,可知甲为SiO2,B为O元素,乙为HCl,A为H元素,C为Na,丙为SiHCl3,据此解答.
解答:解:A、B、C、D、E五种短周期元素,其中元素A、B、C组成的化合物俗称“烧碱”,三元素形成化合物为NaOH;D是最重要半导体材料,它的高纯度单质是制造电脑CPU芯片的主要材料,则D为Si;E的单质是一种常用于杀菌消毒的气体,则E为Cl;结合高纯度D单质的生产流程,可知甲为SiO2,B为O元素,乙为HCl,A为H元素,C为Na,丙为SiHCl3,
(1)Cl-的核外电子排布式为1S22S22P63S23P6,C2B2为Na2O2,其电子式为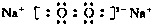 ,
,
故答案为:1S22S22P63S23P6;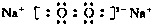 ;
;
(2)同周期自左而右电负性增大,故电负性:Si<Cl,
故答案为:<;
(3)D的氢化物为SiH4,Si原子价层电子对数=4+
=4,Si原子没有孤对电子,故其空间构型为正四面体,化合物丙SiHCl3,Si原子成4个σ键,不含孤对电子,杂化轨道数目为4,采取sp3杂化,SiHCl3的沸点很低,属于分子晶体,
故答案为:正四面体;sp3;分子;
(4)H2O分子间存在氢键,故沸点比较HCl高,
故答案为:H2O分子间存在氢键;
(5)Si单质的结构与金刚石类似,每个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子提供
,则该晶体中Si原子数与Si-Si单键的数目比=1:4×
=1:2,
该晶胞的边长为a cm,则晶胞体积=a3 cm3,晶胞中Si原子数目=4+8×
+6×
=8,晶胞质量=8×
g,则该晶体的密度为=
=
g?cm-3,
故答案为:1:2;
.
(1)Cl-的核外电子排布式为1S22S22P63S23P6,C2B2为Na2O2,其电子式为
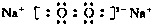 ,
,故答案为:1S22S22P63S23P6;
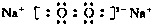 ;
;(2)同周期自左而右电负性增大,故电负性:Si<Cl,
故答案为:<;
(3)D的氢化物为SiH4,Si原子价层电子对数=4+
| 4-1×4 |
| 2 |
故答案为:正四面体;sp3;分子;
(4)H2O分子间存在氢键,故沸点比较HCl高,
故答案为:H2O分子间存在氢键;
(5)Si单质的结构与金刚石类似,每个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子提供
| 1 |
| 2 |
| 1 |
| 2 |
该晶胞的边长为a cm,则晶胞体积=a3 cm3,晶胞中Si原子数目=4+8×
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| NA |
8×
| ||
| a3cm3 |
| 8M |
| a3?NA |
故答案为:1:2;
| 8M |
| a3?NA |
点评:本题考查结构性质位置关系应用、无机物推断、核外电子排布、分子结构、杂化轨道、晶胞计算等,难度中等,注意利用均摊法进行晶胞计算,识记中学常见的晶胞结构.

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.






