摘要:1.本试卷包括第Ⅰ卷和第Ⅱ卷两部分.满分100分.考试时间90分钟.
网址:http://m.1010jiajiao.com/timu3_id_400303[举报]
为除去粗盐中的Ca2+、Mg2+、SO
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是
(2)判断BaCl2已过量的方法是
(3)第④步中,相关的离子方程式是
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是
查看习题详情和答案>>
2- 4 |

(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是
搅拌,加快溶解
搅拌,加快溶解
、引流
引流
.(2)判断BaCl2已过量的方法是
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
.(3)第④步中,相关的离子方程式是
Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
.(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是
会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度
会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度
.(2011?濮阳二模)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如下图所示:

[提出假设]
Ⅰ.所得气体的成分可能只含
Ⅱ.所得气体的成分可能含有
Ⅲ.所得气体的成分可能含有SO2、SO3、O2三种.
[实验探究]
实验操作过程(略).已知实验结束时,硫酸铜完全分解.
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为
(2)实验过程中,仪器C的作用是
[验证假设,分析推理]
(3)若实验结束,B中量筒没有收集到水,则证明猜想
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同.数据如下:
请通过计算,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
①组
查看习题详情和答案>>

[提出假设]
Ⅰ.所得气体的成分可能只含
SO3
SO3
一种;Ⅱ.所得气体的成分可能含有
SO2、O2
SO2、O2
二种;Ⅲ.所得气体的成分可能含有SO2、SO3、O2三种.
[实验探究]
实验操作过程(略).已知实验结束时,硫酸铜完全分解.
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为
①③④⑥⑤②
①③④⑥⑤②
(填序号).(2)实验过程中,仪器C的作用是
吸收SO2、SO3气体
吸收SO2、SO3气体
.[验证假设,分析推理]
(3)若实验结束,B中量筒没有收集到水,则证明猜想
I
I
正确.(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同.数据如下:
| 实验 小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算成标 准状况下气体的体积/mL |
| ① | 6.4 | 2.88 | 224 |
| ② | 6.4 | 2.56 | 448 |
①组
4CuSO4
4CuO+2SO3↑+2SO2↑+O2↑
| ||
4CuSO4
4CuO+2SO3↑+2SO2↑+O2↑
;②组
| ||
2CuSO4
2CuO+2SO2↑+O2↑
| ||
2CuSO4
2CuO+2SO2↑+O2↑
.
| ||
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)步骤②中应加入的试剂是
(2)步骤④中应加入的试剂是
(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是
(4)②③④中所加试剂的顺序也可以调整为
A ③②④B ④③②C ②④③D ④②③
查看习题详情和答案>>

(1)步骤②中应加入的试剂是
BaCl2
BaCl2
溶液,判断此试剂已加过量的方法是取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量.或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量
取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量.或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量
.(2)步骤④中应加入的试剂是
Na2CO3
Na2CO3
溶液,第④步中相关的离子方程式是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
.(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是
会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+
会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+
(4)②③④中所加试剂的顺序也可以调整为
A
A
A ③②④B ④③②C ②④③D ④②③
某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4.某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:
试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是
查看习题详情和答案>>

试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是
加速粗盐的溶解
加速粗盐的溶解
、引流
引流
.(2)第②步操作的目的是除去粗盐中的
Na2SO4
Na2SO4
(填化学式,下同),第⑥步操作的目的是除去滤液中的HCl
HCl
、Na2CO3
Na2CO3
.(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
CaCO3
CaCO3
、BaCO3
BaCO3
(填化学式)(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是
会引入新的杂质KCl
会引入新的杂质KCl
.写出第⑥步涉及的两个化学反应的离子方程式:H++OH-=H2O
H++OH-=H2O
、CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
. 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.第①步:将硼镁矿用浓碱NaOH溶液溶解,过滤得NaBO2溶液.
第②步:将NaBO2浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7?10H2O.
第③步:将硼砂溶于水后,用H2SO4调节酸度,过滤得H3BO3晶体.
第④步:加热硼酸使之脱水生成氧化物.
第⑤步:脱水产物用镁还原即得粗单质硼.请回答下列问题:
(1)第①步和第⑤步的化学方程式分别为
(2)将制得的粗硼在一定条件下反应全部生成BI3,然后BI3热分解可以得到纯净的单质硼.0.20g粗硼制成的BI3分解得到的I2全部被收集后,用 2.00mol/LNa2S2O3溶液滴定,用去27.00mL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-).
①Na2S2O3溶液成碱性,用离子方程式表达其原因
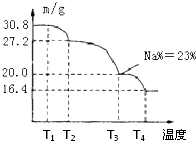
②粗硼中硼的含量为
(3)上述制得的硼砂晶体(Na2B4O7?10H2O)还可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.已知纯品过硼酸钠晶体中各元素的物质的量之比为n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如下图所示,则T3时所得晶体的化学式为: