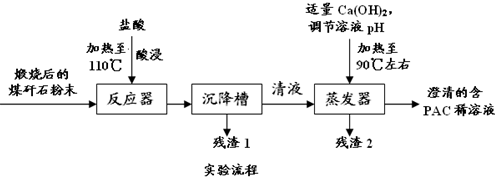
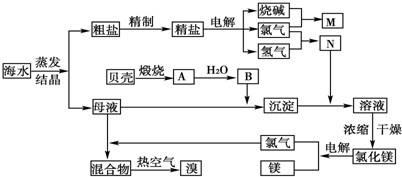
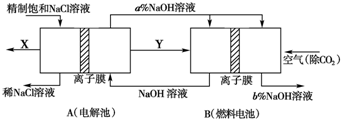
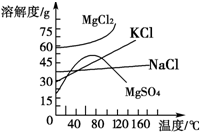
题目内容
某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4.某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:
试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是

试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是
加速粗盐的溶解
加速粗盐的溶解
、引流
引流
.(2)第②步操作的目的是除去粗盐中的
Na2SO4
Na2SO4
(填化学式,下同),第⑥步操作的目的是除去滤液中的HCl
HCl
、Na2CO3
Na2CO3
.(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
CaCO3
CaCO3
、BaCO3
BaCO3
(填化学式)(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是
会引入新的杂质KCl
会引入新的杂质KCl
.写出第⑥步涉及的两个化学反应的离子方程式:H++OH-=H2O
H++OH-=H2O
、CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
.分析:(1)玻璃棒在化学实验中的作用是:搅拌和引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(3)难溶物质和溶液的分离采用过滤的方法;
(4)加入盐酸可以除去过量的碳酸钠和氢氧化钠,根据反应实质来书写离子方程式.
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(3)难溶物质和溶液的分离采用过滤的方法;
(4)加入盐酸可以除去过量的碳酸钠和氢氧化钠,根据反应实质来书写离子方程式.
解答:解:(1)在粗盐提纯时,用玻璃棒溶解,玻璃棒的作用是加速粗盐的溶解,过滤是将固体和液体进行分离的一种操作,玻璃棒在其中的作用是引流,故答案为:加速粗盐的溶解;引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,步骤②是为了除去硫酸钠,第⑥步操作加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,
故答案为:Na2SO4;HCl;Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3以及BaCO3,故答案为:CaCO3;BaCO3;
(4)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,选择的除杂试剂不能用KOH代替NaOH,否则会引入钾离子,第⑥步加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,实质是:H++OH-=H2O,CO32-+2H+=H2O+CO2↑,
故答案为:会引入新的杂质KCl;H++OH-=H2O;CO32-+2H+=H2O+CO2↑.
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,步骤②是为了除去硫酸钠,第⑥步操作加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,
故答案为:Na2SO4;HCl;Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3以及BaCO3,故答案为:CaCO3;BaCO3;
(4)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,选择的除杂试剂不能用KOH代替NaOH,否则会引入钾离子,第⑥步加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,实质是:H++OH-=H2O,CO32-+2H+=H2O+CO2↑,
故答案为:会引入新的杂质KCl;H++OH-=H2O;CO32-+2H+=H2O+CO2↑.
点评:本题主要考查了粗盐提纯时的物质的除杂和净化,注意除杂质时不要引入新的杂质,明确粗盐提纯试剂的加入顺序是解答本题的关键,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
(10)(1)氯碱工业是利用电解食盐水生产 ① 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、 等杂质离子,下列加入顺序合理的是 ②。
等杂质离子,下列加入顺序合理的是 ②。
| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用 ③ ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ④ 。
装置2中滤渣的主要成分为 ⑤ 。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是 ⑦ 。
(10)(1)氯碱工业是利用电解食盐水生产 ① 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、 等杂质离子,下列加入顺序合理的是 ② 。
等杂质离子,下列加入顺序合理的是 ② 。
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
|
成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶于酸的物质 |
|
质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
为生产七水硫酸镁,设计了以下工艺流程:
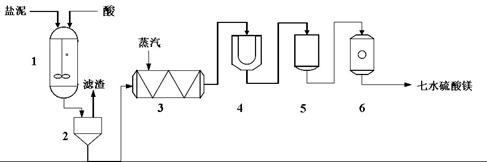
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用 ③ ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ④ 。
装置2中滤渣的主要成分为 ⑤ 。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是 ⑦ 。