摘要:42].温度对反应速率的影响可用阿伦尼乌斯公式的一种形式表示: 式中k1.k2分别为温度T1.T2时某反应的速率常数,E为反应的活化能(假定活化能在温度变化范围不大时是常数).又对同一反应.在不同温度下反应速率常数与反应时间的关系如下: (1)现知在300K.鲜牛奶5小时后即变酸.但在275K的冰箱里可保存50小时.牛奶变酸反应的活化能是多少? (2)若鲜牛奶存放2.5小时后即变酸.则此时温度为多少? C组
网址:http://m.1010jiajiao.com/timu3_id_394919[举报]
氨在国民经济中占有重要的地位,请参与下列探究.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K
该反应在低温下能否自发 (填:能或否).
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)的K=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K= (填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是 (填序号).
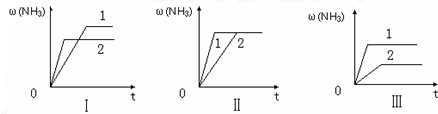
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
查看习题详情和答案>>
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K
该反应在低温下能否自发
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)的K=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是

A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是
2858
2858
kJ;(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol
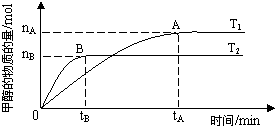
;(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
下列说法正确的是
③④
③④
(填序号)①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=
| nA |
| tA |
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时
| n(H2) |
| n(CH3OH) |
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
| 2-a |
| 2 |
| 2-a |
| 2 |
 为了研究外界条件对H2O2分解反应速率的影响,某同学在四支试管中分别加入3mLH2O2溶液,并测量收集VmL气体所需的时间,实验记录如下:
为了研究外界条件对H2O2分解反应速率的影响,某同学在四支试管中分别加入3mLH2O2溶液,并测量收集VmL气体所需的时间,实验记录如下:| 实验序号 | H2O2溶液浓度 | H2O2溶液温度 | 催化剂 | 所用时间 |
| ① | 5% | 20℃ | 2滴1mol/LFeCl3 | t1 |
| ② | 5% | 40℃ | 2滴1mol/LFeCl3 | t2 |
| ③ | 10% | 20℃ | 2滴1mol/LFeCl3 | t3 |
| ④ | 5% | 20℃ | 不使用 | t4 |
(1)过氧化氢分解的化学方程式是
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(2)实验①②是研究
温度
温度
对反应速率的影响.(3)实验测得t1>t3,原因是
其他条件相同时,实验③的反应物浓度大于实验①的反应物浓度,所以实验③的反应速率大于实验①的反应速率
其他条件相同时,实验③的反应物浓度大于实验①的反应物浓度,所以实验③的反应速率大于实验①的反应速率
.(4)实验①④的测定过程如图,曲线a对应的实验序号是
①
①
(填“①”或“④”).为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇.“绿色自由”构想的部分技术流程如下:
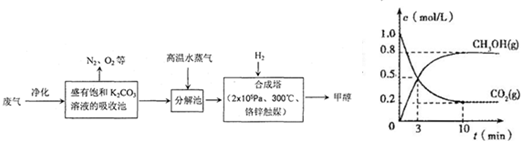
(1)合成塔中反应的化学方程式为
(2)从合成塔分离出甲醇的原理与下列
A.过滤 B.分液 C.蒸馏 D.结晶
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施.“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括
(4)在体积为2L的合成塔中,充入2mol CO2和6mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡,v(H2)=
(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,H2 (g)+
O2(g)=H2O(l)△H2=-285.8kJ/mol写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
查看习题详情和答案>>

(1)合成塔中反应的化学方程式为
CO2+3H2
→CH3OH+H2O
| 一定条件 |
CO2+3H2
→CH3OH+H2O
;△H<0.从平衡移动原理分析,低温有利于提高原料气的平衡转化率.而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了| 一定条件 |
催化剂的催化活性
催化剂的催化活性
.(2)从合成塔分离出甲醇的原理与下列
C
C
操作的原理比较相符(填字母).A.过滤 B.分液 C.蒸馏 D.结晶
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施.“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括
高温水蒸气
高温水蒸气
.(4)在体积为2L的合成塔中,充入2mol CO2和6mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡,v(H2)=
0.24mol/(L?min)
0.24mol/(L?min)
;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有增大H2的用量等
增大H2的用量等
.(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,H2 (g)+
| 1 |
| 2 |
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol
. (2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
(2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
请回答下列问题:
(1)反应①中生成的无色气体A是
CO2
CO2
,滤液①的溶质是NH4F
NH4F
.(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
NH4++H2O NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
NH4+和HCO3-的水解程度基本相同
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-NH4+和HCO3-的水解程度基本相同
NH4++H2O NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
NH4+和HCO3-的水解程度基本相同
. NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-NH4+和HCO3-的水解程度基本相同
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净
取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净
取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净
.(4)温度和NH4HCO3浓度会影响反应①的速率.现设计如下实验方案探究温度和NH4HCO3浓
度对反应①速率的影响.请在表格空白处填写适当的反应条件.
| 实验编号 | 实验目的 | 温度 | c(NH4HCO3) |
| I | 为以下实验作参照 | 60℃ | c1 |
| II | 探究浓度对反应①速率的影响 | c2 | |
| III | 探究温度对反应①速率的影响 | 80℃ |
请分析t2℃时,滤液①中溶质的质量分数下降的原因是
温度升高NH4F会分解
温度升高NH4F会分解
.