题目内容
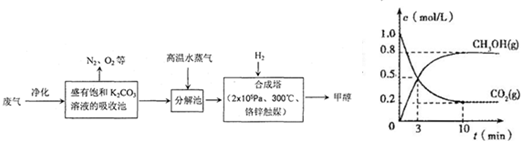
为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇.“绿色自由”构想的部分技术流程如下:
(1)合成塔中反应的化学方程式为
(2)从合成塔分离出甲醇的原理与下列
A.过滤 B.分液 C.蒸馏 D.结晶
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施.“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括
(4)在体积为2L的合成塔中,充入2mol CO2和6mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡,v(H2)=
(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,H2 (g)+
O2(g)=H2O(l)△H2=-285.8kJ/mol写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式

(1)合成塔中反应的化学方程式为
CO2+3H2
→CH3OH+H2O
| 一定条件 |
CO2+3H2
→CH3OH+H2O
;△H<0.从平衡移动原理分析,低温有利于提高原料气的平衡转化率.而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了| 一定条件 |
催化剂的催化活性
催化剂的催化活性
.(2)从合成塔分离出甲醇的原理与下列
C
C
操作的原理比较相符(填字母).A.过滤 B.分液 C.蒸馏 D.结晶
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施.“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括
高温水蒸气
高温水蒸气
.(4)在体积为2L的合成塔中,充入2mol CO2和6mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡,v(H2)=
0.24mol/(L?min)
0.24mol/(L?min)
;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有增大H2的用量等
增大H2的用量等
.(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,H2 (g)+
| 1 |
| 2 |
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol
.分析:(1)根据工艺流程可知,合成塔内反应是氢气与二氧化碳反应生成甲醇和水;
工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
(2)从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大;
(3)由流程图可以找出循环利用的物质;
(4)由图可知,10min达平衡,根据v=
计算v(CH3OH)反应速率之比等于化学计量数之比计算氢气的反应速率;
平衡向正反应移动,可以增大n(CH3OH)/n(CO2)的值;
(5)根据盖斯定律构造目标热化学方程式.
工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
(2)从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大;
(3)由流程图可以找出循环利用的物质;
(4)由图可知,10min达平衡,根据v=
| △c |
| △t |
平衡向正反应移动,可以增大n(CH3OH)/n(CO2)的值;
(5)根据盖斯定律构造目标热化学方程式.
解答:解:(1)合成塔中的反应是二氧化碳和氢气在一定条件下可生成甲醇和水,其方程式为:CO2+3H2
CH3OH+H2O;
温度影响催化剂的活性,除考虑温度对反应速率的影响外,还主要考虑了催化剂的催化活性,
故答案为:CO2+3H2
CH3OH+H2O;催化剂的催化活性;
(2)分离沸点相差比较大,互溶的液体,可以用蒸馏的方法进行分离,故选:C;
(3)由工艺流程可知,可重复利用的物质有K2CO3溶液和CO2、H2、高温水蒸气,故答案为:高温水蒸气;
(4)由图可知,10min达平衡,平衡时甲醇的浓度为0.8mol/L,
所以v(CH3OH)=
=0.08mol/(L?min),反应速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.08mol/(L?min)=0.24mol/(L?min).
增大H2的用量、减少生成H2O 的量等,平衡右移,可以增大n(CH3OH)/n(CO2)的值,
故答案为:0.24mol/(L?min);增大H2的用量等;
(5)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,
②H2 (g)+
O2(g)=H2O(l)△H2=-285.8kJ/mol,
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式可
根据盖斯定律②×4-①得CO2(g)+4H2 (g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol,
故答案为:CO2(g)+4H2 (g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol.
| 一定条件 |
温度影响催化剂的活性,除考虑温度对反应速率的影响外,还主要考虑了催化剂的催化活性,
故答案为:CO2+3H2
| 一定条件 |
(2)分离沸点相差比较大,互溶的液体,可以用蒸馏的方法进行分离,故选:C;
(3)由工艺流程可知,可重复利用的物质有K2CO3溶液和CO2、H2、高温水蒸气,故答案为:高温水蒸气;
(4)由图可知,10min达平衡,平衡时甲醇的浓度为0.8mol/L,
所以v(CH3OH)=
| 0.8mol/L |
| 10min |
增大H2的用量、减少生成H2O 的量等,平衡右移,可以增大n(CH3OH)/n(CO2)的值,
故答案为:0.24mol/(L?min);增大H2的用量等;
(5)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,
②H2 (g)+
| 1 |
| 2 |
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式可
根据盖斯定律②×4-①得CO2(g)+4H2 (g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol,
故答案为:CO2(g)+4H2 (g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol.
点评:本题通过研究二氧化碳对环境的影响,考查学生分析图示及书写方程式的能力、化学反应速率计算、热化学方程式书写等,解题时首先要根据流程图明确物质的制备过程.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目







