网址:http://m.1010jiajiao.com/timu3_id_39005[举报]
(1)W在周期表中的位置:
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2(g)+Y2(g)?2YX3(g)△H
反应各物质的量浓度随时间变化如图:
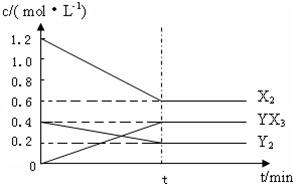
①此反应的平衡常数表达式为
②若升高温度平衡常数K减小,则△H
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是
(5)A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置:________.
(2)在一定条件下,容积为1 L密闭容器中加入1.2 mol X2和0.4 mol Y2,发生如下反应:3X2(g)+Y2(g)![]() 2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
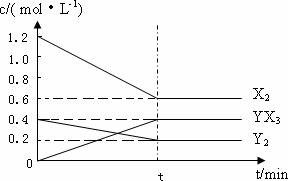
①此反应的平衡常数表达式为________(用化学式表示),K=________.
②若升高温度平衡常数K减小,则ΔH________0(填>,<).
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1 mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为________.
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是________.
(5)A2和B1反应生成B2,则0.2 mol/L A2和0.1 mol/L B1等体积混合后溶液中离子浓度大小关系为________.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置:________.
(2)在一定条件下,容积为1 L密闭容器中加入1.2 mol X2和0.4 mol Y2,发生如下反应:3X2(g)+Y2(g)![]() 2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
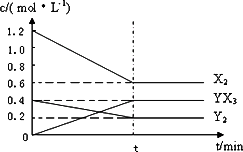
①此反应的平衡常数表达式为________(用化学式表示),K=________.
②若升高温度平衡常数K减小,则ΔH________0(填>,<).
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1 mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为________.
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是________.
(5)A2和B1反应生成B2,则0.2 mol/L A2和0.1 mol/L B1等体积混合后溶液中离子浓度大小关系为________.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图①,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可做火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②。
 |
回答下列问题:
(1)Z的化学式为 ;
(2)E的单质与水反应的离子方程式为 ;
(3)W8空气燃料电池是一种碱性燃料电池,电解质溶液是20﹪~30﹪的KOH溶液。W8空气燃料电池放电时,正极反应式为 ,负极反应式为 ;
(4)将一定量的A2、B2的混合气体放入1L闭密容器中,在500℃、2×107pa下达到平衡。测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol。则该条件下A2的平衡转化率为 ,该温度下的平衡常数为 。
查看习题详情和答案>>(11分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
⑴W在周期表中的位置: 。
⑵在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g) + Y2(g) 2YX3(g) △H 反应各物质的量浓度随时间变化如下:
①此反应的平衡常数表达式为 (用化学式表示) , K= 。
②若升高温度平衡常数K减小,则△H 0(填>,<)。
⑶A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为 。
⑷B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是 。
⑸A2和B1反应生成B2,则0.2mol/LA2和0.1mol/LB1等体积混合后溶液中离子浓度大小关系为 。
查看习题详情和答案>>