摘要:21A.物质结构与性质 A.B.C是原子序数依次递增的短周期元素.A元素原子的电子总数等于其基态电子层数.B元素原子的价电子结构为nsnnpn.C元素的第一电离能在同族元素中最大.并且高于同周期左右相邻的元素.但其单质的熔点却低于同周期左右相邻元素的单质.D的价电子结构为3d64s2.请回答: (1)C与A形成的最简单分子是 分子(填:“极性 或“非极性 ).该分子再与A+元素结合成离子时.键角∠A-C-A发生改变.其原因是 . (2)在由A.B两元素形成的一系列化合物中.若要求所有的原子都有可能在同一个平面中.则对B原子成键轨道的要求是: (3)B元素在一定条件下可形成多种同素异形体.它们有的属原子晶体.有的属分子晶体.有的属混合型晶体.其中某种晶体的一个晶胞中.含有 个B原子.原子晶体能否形成最密堆积结构.原因是 . (4)D晶体的晶胞结构:若D原子的半径是r cm.则晶体D的密度是 . 21B.实验化学 氧化铜是一种黑色固体.可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O.H+.SO42-)能使氧化铜溶解.请你和他一起通过如上右图Ⅰ.Ⅱ和Ⅲ三个实验完成这次探究活动. (1)某同学提出的假设是 . (2)通过实验Ⅰ可以证明 . (3)要证明另外两种粒子能否溶解氧化铜.还需要进行实验Ⅱ和Ⅲ.在Ⅱ中加入稀硫酸后氧化铜溶解.则进一步所做的确认为:在Ⅲ中先加入 .再加入 . (4)探究结果为 . 你认为除实验Ⅱ和Ⅲ所用的试剂外.还能溶解氧化铜的一种常见物质是 . 08届高三化学上册第五次质量检测试题
网址:http://m.1010jiajiao.com/timu3_id_387227[举报]
化学-选修物质结构与性质:A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:①A元素中的一种原子没有中子.
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为
 ,化合物AFD的电子式为
,化合物AFD的电子式为
 ,B2A2的结构式为
,B2A2的结构式为
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
查看习题详情和答案>>
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为
11H
11H
,F简单阴离子的结构示意图



H-C≡C-H
H-C≡C-H
.(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式
NCl3
NCl3
;分子中C、F原子间的化学键的类型为极性键
极性键
(填“极性键”或“非极性键”),属于极性
极性
分子(填“极性”或“非极性”),X与水反应的化学方程式为NCl3+3H2O=NH3+3HClO
NCl3+3H2O=NH3+3HClO
.(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
C3N4
C3N4
,Y的硬度比金刚石硬度大的原因是二者均为原子晶体,N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的硬度比金刚石硬度大
二者均为原子晶体,N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的硬度比金刚石硬度大
.(2012?梧州模拟)[化学--选修物质结构与性质]
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y少的少6个,R与Y同主族,原子序数小于Y.
(1)写出Y的基态原子核外电子排布式
(2)X和Y组成的化合物为
(3)RO2分子中R与O原子间形成的极性共价键为
(4)RO2晶体熔点
查看习题详情和答案>>
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y少的少6个,R与Y同主族,原子序数小于Y.
(1)写出Y的基态原子核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.X、Y、R的电负性大小顺序为O>C>Si
O>C>Si
.(2)X和Y组成的化合物为
原子晶体
原子晶体
晶体,微粒间存在的作用力是共价键
共价键
.(3)RO2分子中R与O原子间形成的极性共价键为
σ键和π键
σ键和π键
键,分子中共价键间键解为180°
180°
.(4)RO2晶体熔点
低于
低于
YX2晶体的熔点,原因是CO2是分子晶体,SiO2是原子晶体
CO2是分子晶体,SiO2是原子晶体
.[化学--选修3:物质结构与性质]
血红素中含有C、O、N、Fe五种元素.回答下列问题:
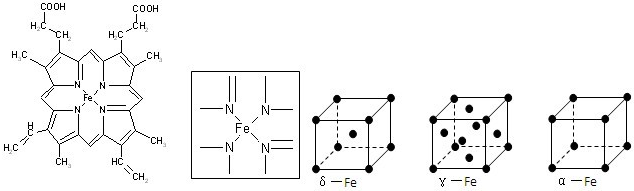
(1)C、N、O、H四种元素中电负性最小的是(填元素符合) ,写出基态Fe原子的核外电子排布式 .
(2)如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.血红素中N原子的杂化方式有 ,在如图的方框内用“→”标出Fe2+的配位键.
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H键断裂,则形成的π键有 mol.
(5)根据等电子原理,写出CN-的电子式,1mol O22+中含有的π键数目为 .
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为 .
查看习题详情和答案>>
血红素中含有C、O、N、Fe五种元素.回答下列问题:

(1)C、N、O、H四种元素中电负性最小的是(填元素符合)
(2)如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.血红素中N原子的杂化方式有
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H键断裂,则形成的π键有
(5)根据等电子原理,写出CN-的电子式,1mol O22+中含有的π键数目为
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为
[化学-物质结构与性质]
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)上述六种元素中,
(2)C元素原子的第一电离能
(3)上述六种元素按电负性从小到大的排列是
(4)C、D、E、F元素形成的最高价氧化物分别是
(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:
查看习题详情和答案>>
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)上述六种元素中,
F
F
元素的原子的第一电离能最大,理由是:其最外层电子数为7,且原子半径小,容易得到电子,不容失去电子
其最外层电子数为7,且原子半径小,容易得到电子,不容失去电子
.(2)C元素原子的第一电离能
>
>
(填“>”“<”“=”)D,理由是:Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构
Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构
.(3)上述六种元素按电负性从小到大的排列是
Mg、Al、P、S、O、F
Mg、Al、P、S、O、F
.(4)C、D、E、F元素形成的最高价氧化物分别是
MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物
MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物
(填“离子”“共价”)化合物.(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:
H2SO4、H3PO4、Al(OH)3、Mg(OH)2
H2SO4、H3PO4、Al(OH)3、Mg(OH)2
.【选修3--物质结构与性质】
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%.推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.请回答下列问题:
(1)写出As基态原子的价电子排布式: .
(2)As的第一电离能比Ga的 (填“大”或“小”,下同),As的电负性比Ga的 .
(3)比较As的简单氢化物与同族第二、三周期元素所形成的简单氢化物的沸点,并说明理由: .
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与 个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为 .在四大晶体类型中,GaAs属于 晶体.
(5)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,此反应的化学方程式为 ;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化轨道类型为 .
查看习题详情和答案>>
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%.推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.请回答下列问题:
(1)写出As基态原子的价电子排布式:
(2)As的第一电离能比Ga的
(3)比较As的简单氢化物与同族第二、三周期元素所形成的简单氢化物的沸点,并说明理由:
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与
(5)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,此反应的化学方程式为