题目内容
[化学--选修3:物质结构与性质]
血红素中含有C、O、N、Fe五种元素.回答下列问题:
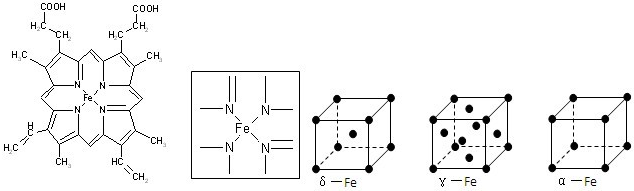
(1)C、N、O、H四种元素中电负性最小的是(填元素符合) ,写出基态Fe原子的核外电子排布式 .
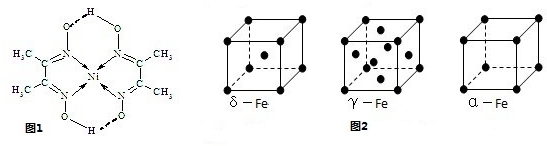
(2)如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.血红素中N原子的杂化方式有 ,在如图的方框内用“→”标出Fe2+的配位键.
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H键断裂,则形成的π键有 mol.
(5)根据等电子原理,写出CN-的电子式,1mol O22+中含有的π键数目为 .
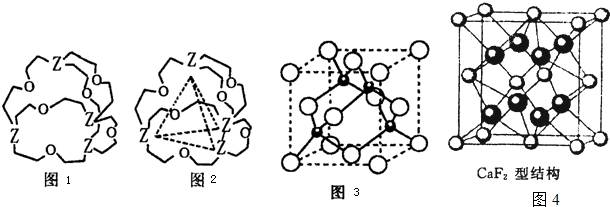
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为 .
血红素中含有C、O、N、Fe五种元素.回答下列问题:

(1)C、N、O、H四种元素中电负性最小的是(填元素符合)
(2)如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.血红素中N原子的杂化方式有
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H键断裂,则形成的π键有
(5)根据等电子原理,写出CN-的电子式,1mol O22+中含有的π键数目为
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为
分析:(1)、根据元素周期表电负性的递变规律比较电负性强弱;根据核外电子排布规律书写基态Fe原子的核外电子排布式;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化;
(3)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(4)根据氮氢键和生成气体、π键之间的关系式计算;
(5)根据氮气分子的电子式写出CN-的电子式,注意该微粒是离子;根据O22+的电子式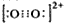 ,算出1mol O22+中含有的π键数目;
,算出1mol O22+中含有的π键数目;
(6)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的
 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化;(3)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(4)根据氮氢键和生成气体、π键之间的关系式计算;
(5)根据氮气分子的电子式写出CN-的电子式,注意该微粒是离子;根据O22+的电子式
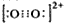 ,算出1mol O22+中含有的π键数目;
,算出1mol O22+中含有的π键数目;(6)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值
解答:解:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,
基态Fe原子的核外价电子排布式为:[Ar]3d64S2,
故答案是:H;[Ar]3d64S2;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,
故答案为:sp2、sp3;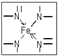 ;
;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,
故答案为:>;
(4)若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成氮气1.5mol,形成的π键有1.5mol×2=3mol,
故答案为:3;
(5)根据氮气分子的电子式写出CN-的电子式,且CN-是离子,符合离子电子式的书写规则,所以其电子式为: ,
,
根据等电子体原理可知,O22+的电子式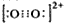 ,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,
,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,
故答案是: ;2NA;
;2NA;
(6)γ晶体晶胞中所含有的铁原子数为8×
+6×
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,
故答案为:4; 4:3.
基态Fe原子的核外价电子排布式为:[Ar]3d64S2,
故答案是:H;[Ar]3d64S2;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的
 ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,故答案为:sp2、sp3;
 ;
;(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,
故答案为:>;
(4)若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成氮气1.5mol,形成的π键有1.5mol×2=3mol,
故答案为:3;
(5)根据氮气分子的电子式写出CN-的电子式,且CN-是离子,符合离子电子式的书写规则,所以其电子式为:
 ,
,根据等电子体原理可知,O22+的电子式
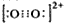 ,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,
,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,故答案是:
 ;2NA;
;2NA;(6)γ晶体晶胞中所含有的铁原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4; 4:3.
点评:本题考查较为综合,涉及电负性、电子排布图、配位键、杂化方式等问题,题目数量,本题难度较大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
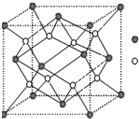
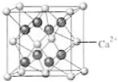 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是