题目内容
【选修3--物质结构与性质】
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%.推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.请回答下列问题:
(1)写出As基态原子的价电子排布式: .
(2)As的第一电离能比Ga的 (填“大”或“小”,下同),As的电负性比Ga的 .
(3)比较As的简单氢化物与同族第二、三周期元素所形成的简单氢化物的沸点,并说明理由: .
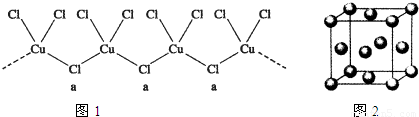
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与 个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为 .在四大晶体类型中,GaAs属于 晶体.
(5)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,此反应的化学方程式为 ;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化轨道类型为 .
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%.推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.请回答下列问题:
(1)写出As基态原子的价电子排布式:
(2)As的第一电离能比Ga的
(3)比较As的简单氢化物与同族第二、三周期元素所形成的简单氢化物的沸点,并说明理由:
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与
(5)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,此反应的化学方程式为
分析:(1)As是35号元素,属于主族元素,其最外层电子就是其价电子;
(2)同一周期元素中,元素的电负性随着原子序数的增大而增大,第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;
(3)同一主族元素中,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物的沸点较大;
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体;根据其构成微粒确定晶体类型;
(5)根据元素守恒确定另外一种生成物,根据反应物、生成物和反应条件写出反应方程式;
根据(CH3)3Ga中镓原子含有的价电子对个数确定其杂化类型.
(2)同一周期元素中,元素的电负性随着原子序数的增大而增大,第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;
(3)同一主族元素中,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物的沸点较大;
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体;根据其构成微粒确定晶体类型;
(5)根据元素守恒确定另外一种生成物,根据反应物、生成物和反应条件写出反应方程式;
根据(CH3)3Ga中镓原子含有的价电子对个数确定其杂化类型.
解答:解:(1)As是35号元素,属于主族元素,其最外层电子就是其价电子,所以As基态原子的价电子排布式:4s24p3,故答案为:4s24p3;
(2)同一周期元素中,元素的电负性随着原子序数的增大而增大,第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,Ga属于第IVA族、As属于第VA族,所以As的第一电离能比Ga的大,As的电负性比Ga的大,
故答案为:大;大;
(3)氨气分子间形成氢键,氢键的存在导致氨气的沸点最高,砷化氢的相对分子质量大于磷化氢,分子间作用力大,所以砷化氢的沸点比磷化氢的高,则这几种氢化物的沸点高低顺序是:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;氨气分子间形成氢键,沸点最高,砷化氢的相对分子质量比磷化氢大,分子间作用力大,所以砷化氢的沸点比磷化氢高;
(4)GaAs的晶体结构与单晶硅相似,根据硅晶体结构知,在GaAs晶体中,每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体,GaAs的晶体结构和硅晶体相似,则晶体类型相似,所以GaAs属于原子晶体,故答案为:4;正四面体;原子;
(5)根据元素守恒知,另外一种生成物是CH4,根据反应物、生成物及反应条件知,其反应方程式为:(CH3)3Ga+AsH3
GaAs+3CH4,
(CH3)3Ga为非极性分子,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:(CH3)3Ga+AsH3
GaAs+3CH4;sp2.
(2)同一周期元素中,元素的电负性随着原子序数的增大而增大,第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,Ga属于第IVA族、As属于第VA族,所以As的第一电离能比Ga的大,As的电负性比Ga的大,
故答案为:大;大;
(3)氨气分子间形成氢键,氢键的存在导致氨气的沸点最高,砷化氢的相对分子质量大于磷化氢,分子间作用力大,所以砷化氢的沸点比磷化氢的高,则这几种氢化物的沸点高低顺序是:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;氨气分子间形成氢键,沸点最高,砷化氢的相对分子质量比磷化氢大,分子间作用力大,所以砷化氢的沸点比磷化氢高;
(4)GaAs的晶体结构与单晶硅相似,根据硅晶体结构知,在GaAs晶体中,每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体,GaAs的晶体结构和硅晶体相似,则晶体类型相似,所以GaAs属于原子晶体,故答案为:4;正四面体;原子;
(5)根据元素守恒知,另外一种生成物是CH4,根据反应物、生成物及反应条件知,其反应方程式为:(CH3)3Ga+AsH3
| ||
(CH3)3Ga为非极性分子,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:(CH3)3Ga+AsH3
| ||
点评:本题考查了原子结构和性质,涉及晶体类型的判断、分子空间结构类型的判断、原子杂化方式的判断、电负性和第一电离能大小规律等知识点,这些都是考试热点,要重点掌握.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目