摘要:在周期表中同周期的X.Y.Z三种元素.已知它们的最高价氧化物对应的水化物是HXO4.H2YO4.H3ZO4.则以下判断正确的是 A.含氧酸的酸性H3ZO4 > H2YO4 > HXO4 B.非金属性X < Y < Z C.气态氢化物稳定性按XYZ顺序由弱到强 D.元素的负化合价的绝对值按XYZ顺序由小到大
网址:http://m.1010jiajiao.com/timu3_id_384901[举报]
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
第2周期VIA族
第2周期VIA族
.(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
氢键
氢键
.(3)①C在一定条件下反应生成A的化学方程式是
4NH3+5O2=4NO+6H2O
4NH3+5O2=4NO+6H2O
.②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐.该盐的水溶液pH
小于
小于
7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的有
ad
ad
.a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大.
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F.已知:化合物A、B、C中原子个数比都为1:1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等.请回答下列问题:
(1)X元素的名称是
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)
(3)写出F的电子式

(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应.请写出X单质、B分别与E反应的化学方程式
B中含有的化学键是
(5)请写出由化合物C制取Y的单质反应的化学方程式
查看习题详情和答案>>
(1)X元素的名称是
钠
钠
,它在周期表中的位置第三周期第IA族
第三周期第IA族
.(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)
Na>O>H
Na>O>H
(3)写出F的电子式


(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应.请写出X单质、B分别与E反应的化学方程式
2Na+2H2O=4NaOH+H2↑
2Na+2H2O=4NaOH+H2↑
,2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;B中含有的化学键是
离子键和非极性键
离子键和非极性键
;(5)请写出由化合物C制取Y的单质反应的化学方程式
2H2O2 2H2O+O2↑
2H2O+O2↑
 2H2O+O2↑
2H2O+O2↑2H2O2 2H2O+O2↑
2H2O+O2↑
. 2H2O+O2↑
2H2O+O2↑X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图1所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.
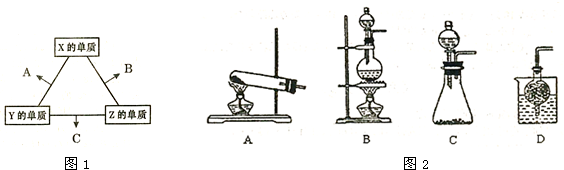
请回答下列问题:
(1)由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)由大到小的顺序是 (填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,发生如下反应:4NH3+3O2=2N2+6H2O,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正“或“负“).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每1mol乙参加反应有4mol电子转移,该反应的化学方程式为 .
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是 .
③实验室可用甲作试剂取X的单质,发生装置可选用如图2所示的 (填装置代号).
查看习题详情和答案>>

请回答下列问题:
(1)由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,发生如下反应:4NH3+3O2=2N2+6H2O,试写出该电池负极的电极反应式
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每1mol乙参加反应有4mol电子转移,该反应的化学方程式为
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol-L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
③实验室可用甲作试剂取X的单质,发生装置可选用如图2所示的
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图1变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
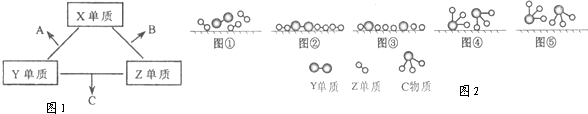
(1)X元素在周期表中的位置是 周期, 族.
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们 .
(3)C的电子式是 ; Z单质与Y单质在固体催化剂表面合成C的反应过程,示意如图2.
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是 .
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K= ;用物质C表示该反应的反应速率为 .
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式 .用该反应合成1mol液态甲醇吸收热量131.9kJ,
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式 .
查看习题详情和答案>>

(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们
(3)C的电子式是
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K=
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式
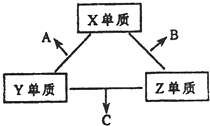 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: