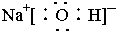题目内容
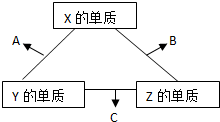
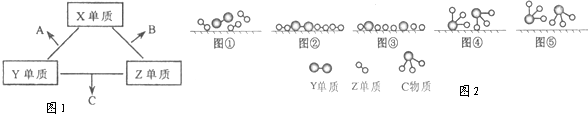
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图1变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是 周期, 族.
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们 .
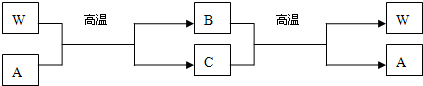
(3)C的电子式是 ; Z单质与Y单质在固体催化剂表面合成C的反应过程,示意如图2.
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是 .
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K= ;用物质C表示该反应的反应速率为 .
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式 .用该反应合成1mol液态甲醇吸收热量131.9kJ,
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式 .

(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们
(3)C的电子式是
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K=
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式
分析:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),B、C两种分子中的电子数均等于10,则B、C为H2O、NH3的一种,且一个B分子中含有的Z原子个数比C分子中少1个,B为H2O,C为NH3,由转化关系可知,Z为氢,故A为NO,X为氧,Y为氮,
(1)O元素的质子数为8,位于第2周期VIA族;
(2)根据氢键对物质的沸点的影响来分析;
(3)由上面分析可知,C为NH3,是共价化合物,根据电子式书写规则写;根据图中的微粒分析;
(4)利用三段式求出平衡时的浓度,然后求出K,根据氨气的浓度变化求出其速率;
(5)根据元素守恒和原子守恒书写化学方程式;根据已知热化学方程式,利用盖斯定律计算.
(1)O元素的质子数为8,位于第2周期VIA族;
(2)根据氢键对物质的沸点的影响来分析;
(3)由上面分析可知,C为NH3,是共价化合物,根据电子式书写规则写;根据图中的微粒分析;
(4)利用三段式求出平衡时的浓度,然后求出K,根据氨气的浓度变化求出其速率;
(5)根据元素守恒和原子守恒书写化学方程式;根据已知热化学方程式,利用盖斯定律计算.
解答:解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),B、C两种分子中的电子数均等于10,则B、C为H2O、NH3的一种,且一个B分子中含有的Z原子个数比C分子中少1个,B为H2O,C为NH3,由转化关系可知,Z为氢,故A为NO,X为氧,Y为氮,
(1)O元素的质子数为8,位于第二周期VIA族,故答案为:二;VIA;
(2)氧元素、氟元素电负性很强,水分子之间、氨气分子之间存在氢键,故它们的沸点高于同主族其它元素氢化物,故答案为:分子之间存在氢键;
(3)由上面分析可知,C为NH3,是共价化合物,则其电子式为: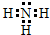 ;由图可知③中全部为单个原子,所以图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是③,故答案为:
;由图可知③中全部为单个原子,所以图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是③,故答案为: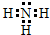 ;③;
;③;
(4)20min时反应已达平衡,N2的物质的量浓度为0.8mol/L,设参加反应的N2的物质的量为xmol/L,
N2 +3H2 ?2NH3
初始浓度(mol/L):1 3 0
变化浓度(mol/L):x 3x 2x
平衡浓度(mol/L):1-x 3-3x 2x
则1-x=0.8mol/L,所以x=0.2mol/L,所以平衡时的浓度分别为c(N2)=0.8mol/L,c(H2)=2.4mol/L,c(NH3)=0.4mol/L,
所以K=
=
,
v(NH3)=
=
=0.02 mol/(L?min),
故答案为:
; 0.02 mol/(L?min);
(5)根据题意由CO和H2生产甲醇,则其化学方程式为CO+2H2=CH3OH;
根据液态甲醇燃烧生成二氧化碳和水蒸气,化学方程式为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H,
①CO(g)+2H2(g)=CH3OH(l)△H1=+131.9kJ?mol-1
②4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1188.2kL/mol
③H2O(g)=H2O(l)△H=3-44.0kL/mol
④CH3OH(l)+
O2(g)═CO2(g)+2H2O(l))△H
盖斯定律根据得:④=
×②-①+2×③
则△H=
×△H2-△H1+2×△H3=-814.0 kJ?mol-1,
故答案为:CO+2H2=CH3OH;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-814.0 kJ?mol-1.
(1)O元素的质子数为8,位于第二周期VIA族,故答案为:二;VIA;
(2)氧元素、氟元素电负性很强,水分子之间、氨气分子之间存在氢键,故它们的沸点高于同主族其它元素氢化物,故答案为:分子之间存在氢键;
(3)由上面分析可知,C为NH3,是共价化合物,则其电子式为:
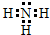 ;由图可知③中全部为单个原子,所以图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是③,故答案为:
;由图可知③中全部为单个原子,所以图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是③,故答案为: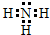 ;③;
;③;(4)20min时反应已达平衡,N2的物质的量浓度为0.8mol/L,设参加反应的N2的物质的量为xmol/L,
N2 +3H2 ?2NH3
初始浓度(mol/L):1 3 0
变化浓度(mol/L):x 3x 2x
平衡浓度(mol/L):1-x 3-3x 2x
则1-x=0.8mol/L,所以x=0.2mol/L,所以平衡时的浓度分别为c(N2)=0.8mol/L,c(H2)=2.4mol/L,c(NH3)=0.4mol/L,
所以K=
| c(NH3) |
| c(N2)?c3(H2) |
| 0.42 |
| 0.8×2.42 |
v(NH3)=
| △c |
| t |
| 0.4mol/L |
| 20min |
故答案为:
| 0.42 |
| 0.8×2.42 |
(5)根据题意由CO和H2生产甲醇,则其化学方程式为CO+2H2=CH3OH;
根据液态甲醇燃烧生成二氧化碳和水蒸气,化学方程式为:CH3OH(l)+
| 3 |
| 2 |
①CO(g)+2H2(g)=CH3OH(l)△H1=+131.9kJ?mol-1
②4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1188.2kL/mol
③H2O(g)=H2O(l)△H=3-44.0kL/mol
④CH3OH(l)+
| 3 |
| 2 |
盖斯定律根据得:④=
| 1 |
| 2 |
则△H=
| 1 |
| 2 |
故答案为:CO+2H2=CH3OH;CH3OH(l)+
| 3 |
| 2 |
点评:本题考查了化学平衡的计算,速率、平衡常数的计算,元素的推断,电子式的书写,盖斯定律的应用等,涉及的知识点较多,题目综合性强,难度较大.

练习册系列答案
相关题目