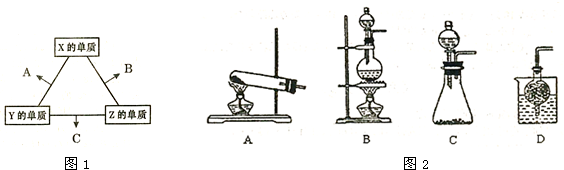
题目内容
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F.已知:化合物A、B、C中原子个数比都为1:1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等.请回答下列问题:
(1)X元素的名称是
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)
(3)写出F的电子式

(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应.请写出X单质、B分别与E反应的化学方程式
B中含有的化学键是
(5)请写出由化合物C制取Y的单质反应的化学方程式
(1)X元素的名称是
钠
钠
,它在周期表中的位置第三周期第IA族
第三周期第IA族
.(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)
Na>O>H
Na>O>H
(3)写出F的电子式


(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应.请写出X单质、B分别与E反应的化学方程式
2Na+2H2O=4NaOH+H2↑
2Na+2H2O=4NaOH+H2↑
,2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;B中含有的化学键是
离子键和非极性键
离子键和非极性键
;(5)请写出由化合物C制取Y的单质反应的化学方程式
2H2O2 2H2O+O2↑
2H2O+O2↑
 2H2O+O2↑
2H2O+O2↑2H2O2 2H2O+O2↑
2H2O+O2↑
. 2H2O+O2↑
2H2O+O2↑分析:(1)B为淡黄色固体可推测为Na2O2,三种元素中有Na和O.C、E常温为液体,推测为H2O2和H2O,可知三种元素还包括H.A为XZ的离子化合物,可知A为NaH,X为Na,Y为O,Z为H.
A为NaH,B为Na2O2,C为H2O2,D为Na2O,E为H2O,F为NaOH;
(2)同周期从左到右半径逐渐减小,同主族从上到下逐渐增大;
(3)F的化学式:NaOH;
(4)X为Na,B为Na2O2,E为H2O,B是过氧化钠,含有钠离子和过氧根离子;
(5)C为H2O2,Y为O.
A为NaH,B为Na2O2,C为H2O2,D为Na2O,E为H2O,F为NaOH;
(2)同周期从左到右半径逐渐减小,同主族从上到下逐渐增大;
(3)F的化学式:NaOH;
(4)X为Na,B为Na2O2,E为H2O,B是过氧化钠,含有钠离子和过氧根离子;
(5)C为H2O2,Y为O.
解答:解:(1)B为淡黄色固体可推测为Na2O2,三种元素中有Na和O.C、E常温为液体,推测为H2O2和H2O,可知三种元素还包括H.A为XZ的离子化合物,可知A为NaH,X为Na,Y为O,Z为H.则A为NaH,B为Na2O2,C为H2O2,D为Na2O,E为H2O,F为NaOH.故X元素的名称是:钠.它在周期表中的位置:第三周期第IA族.故答案为:钠;第三周期第IA族;
(2)同周期从左到右半径逐渐减小,同主族从上到下逐渐增大,X、Y、Z的原子半径从大到小的顺序是(用元素符号表示):Na>O>H,故答案为:Na>O>H;
(3)F的化学式:NaOH.F的电子式: ,故答案为:
,故答案为: ;
;
(4)X为Na,B为Na2O2,E为H2O,X单质、B分别与E反应的化学方程式:2Na+2H2O=4NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,B是过氧化钠,含有钠离子和过氧根离子.故含离子键,过氧根离子内两个氧原子间是非极性键,故答案为:2Na+2H2O=4NaOH+H2↑;2Na2O2+2H2O=4NaOH+O2↑;离子键和非极性键;
(5)C为H2O2,Y为O,反应的化学方程式:2H2O2 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2  2H2O+O2↑.
2H2O+O2↑.
(2)同周期从左到右半径逐渐减小,同主族从上到下逐渐增大,X、Y、Z的原子半径从大到小的顺序是(用元素符号表示):Na>O>H,故答案为:Na>O>H;
(3)F的化学式:NaOH.F的电子式:
 ,故答案为:
,故答案为: ;
;(4)X为Na,B为Na2O2,E为H2O,X单质、B分别与E反应的化学方程式:2Na+2H2O=4NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,B是过氧化钠,含有钠离子和过氧根离子.故含离子键,过氧根离子内两个氧原子间是非极性键,故答案为:2Na+2H2O=4NaOH+H2↑;2Na2O2+2H2O=4NaOH+O2↑;离子键和非极性键;
(5)C为H2O2,Y为O,反应的化学方程式:2H2O2
 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2  2H2O+O2↑.
2H2O+O2↑.点评:本题考查元素周期表,原子结构,元素及其化合物的性质,化学键,难度适中.

练习册系列答案
相关题目