题目内容
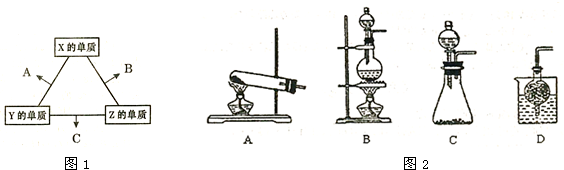
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
第2周期VIA族
第2周期VIA族
.(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
氢键
氢键
.(3)①C在一定条件下反应生成A的化学方程式是
4NH3+5O2=4NO+6H2O
4NH3+5O2=4NO+6H2O
.②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐.该盐的水溶液pH
小于
小于
7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的有
ad
ad
.a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大.
分析:X、Y、Z三种短周期元素,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体,一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,则Z为H,C为NH3,B为H2O,所以X为O,Y为N,X与Y反应生成A,即A为NO.
(1)N元素的质子数为7;
(2)根据氢键对物质的熔沸点的影响来分析;
(3)氨气与氧气反应生成NO和水;硝酸与氨气反应生成硝酸铵,水解显酸性;
(4)根据N2+3H2
2NH3 △H<0,结合化学平衡的移动及平衡状态的判断来分析.
(1)N元素的质子数为7;
(2)根据氢键对物质的熔沸点的影响来分析;
(3)氨气与氧气反应生成NO和水;硝酸与氨气反应生成硝酸铵,水解显酸性;
(4)根据N2+3H2
| 高温高压 |
| 催化剂 |
解答:解:X、Y、Z三种短周期元素,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体,一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,则Z为H,C为NH3,B为H2O,所以X为O,Y为N,X与Y反应生成A,即A为NO.
(1)N元素的质子数为7,位于第2周期VIA族,故答案为:第2周期VIA族;
(2)因水分子、氨气分子中含有氢键,则它们的熔沸点较高,故答案为:氢键;
(3)①氨气与氧气反应生成NO和水,则反应为4NH3+5O2=4NO+6H2O,故答案为:4NH3+5O2=4NO+6H2O;
②硝酸与氨气反应生成硝酸铵,水解显酸性,pH<7,水解反应为NH4++H2O NH3?H2O+H+,故答案为:小于;NH4++H2O
NH3?H2O+H+,故答案为:小于;NH4++H2O NH3?H2O+H+;
NH3?H2O+H+;
(4)由N2+3H2
2NH3 △H<0,
a.由化学平衡的特征可知,达到化学平衡时,正反应速率与逆反应速率相等,故a正确;
b.等物质的量的Y、Z两种单质反应,反应过程中达到平衡时Y的转化未知,则Y单质的体积分数不确定,不一定为
50%,故b错误;
c.Y、Z以1:3的体积比转化,则达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比不能为1:1,故c错误;
d.由质量守恒可知,质量不变,但反应中气体的物质的量减小,则由M=
可知达到化学平衡的过程中气体平均相对分子质量减小,故d正确;
e.反应为放热反应,升高温度逆向移动,则达到化学平衡后,升高温度,C的体积分数减小,故e错误;
故选ad.
(1)N元素的质子数为7,位于第2周期VIA族,故答案为:第2周期VIA族;
(2)因水分子、氨气分子中含有氢键,则它们的熔沸点较高,故答案为:氢键;
(3)①氨气与氧气反应生成NO和水,则反应为4NH3+5O2=4NO+6H2O,故答案为:4NH3+5O2=4NO+6H2O;
②硝酸与氨气反应生成硝酸铵,水解显酸性,pH<7,水解反应为NH4++H2O
 NH3?H2O+H+,故答案为:小于;NH4++H2O
NH3?H2O+H+,故答案为:小于;NH4++H2O NH3?H2O+H+;
NH3?H2O+H+;(4)由N2+3H2
| 高温高压 |
| 催化剂 |
a.由化学平衡的特征可知,达到化学平衡时,正反应速率与逆反应速率相等,故a正确;
b.等物质的量的Y、Z两种单质反应,反应过程中达到平衡时Y的转化未知,则Y单质的体积分数不确定,不一定为
50%,故b错误;
c.Y、Z以1:3的体积比转化,则达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比不能为1:1,故c错误;
d.由质量守恒可知,质量不变,但反应中气体的物质的量减小,则由M=
| m |
| n |
e.反应为放热反应,升高温度逆向移动,则达到化学平衡后,升高温度,C的体积分数减小,故e错误;
故选ad.
点评:本题为综合性题,考查原子结构与元素周期律、化学平衡、水解等主要知识点,难度较大,根据信息来推断元素是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目