摘要:21A.物质结构与性质 A.B.C.D.E.F是元素周期表前四周期的元素.它们在元素周期中的位置如下图所示: (1)写出F的基态原子核外电子排布式: . (2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是 . (3)由A.B.D三种元素形成的一种物质俗称光气.分子中A原子采取sp2杂化成键.光气分子的结构式是 .其中碳氧原子之间共价键是 : a.2个σ键 b.2个π键 c.1个σ键.1个π键 (4)EB晶胞如右图所示.EB晶体中E2+的配位数为 .EB晶体和NaCl晶体中离子排列方式相同.其晶格能分别为:EB 401 kJ·mol-1.NaCl 86 kJ·mol-1.导致两者晶格能差异的主要原因是 . (5)现有含F的两种颜色的晶体.一种为紫色.另一为绿色.它们都是配位数为6的配合物(配离子难电离).相关实验证明.两种晶体的组成皆为FD3·6H2O.为测定这两种晶体的化学式.取等质量的两种晶体分别配成待测溶液.各滴入足量的AgNO3溶液.原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3. 则紫色晶体配合物的化学式为 .绿色晶体中含有化学键类型是 . (1)[Ar]3d24s2或1s22s22p63s23p63d24s2磷原子的外围电子排布:3s23p3 处于半充满稳定结构.EB晶体中离子均为二价离子.所带电量较Na+.Cl-大[Ti(H2O)6]Cl3 离子键.共价键.配位键 21B.实验化学 在学习 “几种重要的金属化合物 时.同学上台演示以下两个实验: (1)提出问题 教师引导:实验一CO2能灭火.实验二的CO2为何能“点火 ? (2)假设与猜想 ①Na2O2与CO2发生了反应.可能有Na2CO3生成,②棉花燃烧.说明该反应放热.使温度达到了棉花的着火点,③剧烈燃烧.反应中可能有 生成. (3)设计并进行实验.观察.解释和结论 请你帮助他们完成下表: 实 验 步 骤 实验现象 原因和结论 Ⅰ 用小矿泉水瓶收集满CO2,再向瓶中加 入不同量浅黄色的Na2O2,振荡后用燃着的木条伸向瓶中 第①小组放入少量的Na2O2 木条未复燃.固体由浅黄色全部变为白色. 第②小组放入的Na2O2稍多一些 木条复燃.部分固体变为白色 Na2O2过量(或CO2不足).瓶中CO2少O2多,Na2O2部分发生反应 Ⅱ 两小组均用手触摸瓶的底部 瓶底发热 Ⅲ 两小组都各取少量白色固体于试管中.滴入稀盐酸并 .将产生的 . 有气泡放出. 有CO32-存在.说明生成物中有Na2CO3. (4)类比推理 Na2O2与H2O反应后应该有NaOH和O2生成.则向包有Na2O2的棉花上滴两滴水.棉花也应剧烈燃烧,向生成的溶液中滴入酚酞应该变红色. (5)实验与解释 ①向小烧杯中包有Na2O2的脱脂棉上滴两滴水.发现有气泡产生.杯底发热.但棉花没有燃烧.其原因可能是 , ②向杯中的溶液滴入酚酞.溶液变红色.振荡后红色消失.其原因可能是 . (6)联想与启示:保存Na2O2的注意事项为: . 氧气(或O2),Ⅰ:可能CO2过量(或Na2O2不足)瓶中O2少CO2多. Na2O2全部发生了反应 Ⅱ:该反应为放热反应 Ⅲ:塞上带导管的橡胶塞.气体通入澄清石灰水 澄清石灰水变浑浊①Na2O2部分变质或滴入的水太多 ②生成的NaOH使酚酞变红色.但Na2O2(生成溶液中的H2O2)的强氧化性将酚酞氧化而漂白要用塑料袋认真密封存放在干燥的阴暗处
网址:http://m.1010jiajiao.com/timu3_id_381634[举报]
化学-选修物质结构与性质:A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:①A元素中的一种原子没有中子.
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为
 ,化合物AFD的电子式为
,化合物AFD的电子式为
 ,B2A2的结构式为
,B2A2的结构式为
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
查看习题详情和答案>>
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为
11H
11H
,F简单阴离子的结构示意图



H-C≡C-H
H-C≡C-H
.(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式
NCl3
NCl3
;分子中C、F原子间的化学键的类型为极性键
极性键
(填“极性键”或“非极性键”),属于极性
极性
分子(填“极性”或“非极性”),X与水反应的化学方程式为NCl3+3H2O=NH3+3HClO
NCl3+3H2O=NH3+3HClO
.(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
C3N4
C3N4
,Y的硬度比金刚石硬度大的原因是二者均为原子晶体,N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的硬度比金刚石硬度大
二者均为原子晶体,N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的硬度比金刚石硬度大
.(2012?梧州模拟)[化学--选修物质结构与性质]
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y少的少6个,R与Y同主族,原子序数小于Y.
(1)写出Y的基态原子核外电子排布式
(2)X和Y组成的化合物为
(3)RO2分子中R与O原子间形成的极性共价键为
(4)RO2晶体熔点
查看习题详情和答案>>
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y少的少6个,R与Y同主族,原子序数小于Y.
(1)写出Y的基态原子核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.X、Y、R的电负性大小顺序为O>C>Si
O>C>Si
.(2)X和Y组成的化合物为
原子晶体
原子晶体
晶体,微粒间存在的作用力是共价键
共价键
.(3)RO2分子中R与O原子间形成的极性共价键为
σ键和π键
σ键和π键
键,分子中共价键间键解为180°
180°
.(4)RO2晶体熔点
低于
低于
YX2晶体的熔点,原因是CO2是分子晶体,SiO2是原子晶体
CO2是分子晶体,SiO2是原子晶体
.[化学--选修3:物质结构与性质]
血红素中含有C、O、N、Fe五种元素.回答下列问题:
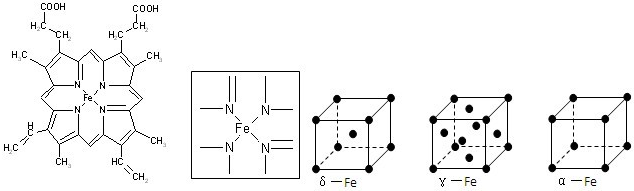
(1)C、N、O、H四种元素中电负性最小的是(填元素符合) ,写出基态Fe原子的核外电子排布式 .
(2)如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.血红素中N原子的杂化方式有 ,在如图的方框内用“→”标出Fe2+的配位键.
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H键断裂,则形成的π键有 mol.
(5)根据等电子原理,写出CN-的电子式,1mol O22+中含有的π键数目为 .
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为 .
查看习题详情和答案>>
血红素中含有C、O、N、Fe五种元素.回答下列问题:

(1)C、N、O、H四种元素中电负性最小的是(填元素符合)
(2)如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构式.血红素中N原子的杂化方式有
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H键断裂,则形成的π键有
(5)根据等电子原理,写出CN-的电子式,1mol O22+中含有的π键数目为
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为
[化学-物质结构与性质]
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)上述六种元素中,
(2)C元素原子的第一电离能
(3)上述六种元素按电负性从小到大的排列是
(4)C、D、E、F元素形成的最高价氧化物分别是
(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:
查看习题详情和答案>>
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)上述六种元素中,
F
F
元素的原子的第一电离能最大,理由是:其最外层电子数为7,且原子半径小,容易得到电子,不容失去电子
其最外层电子数为7,且原子半径小,容易得到电子,不容失去电子
.(2)C元素原子的第一电离能
>
>
(填“>”“<”“=”)D,理由是:Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构
Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构
.(3)上述六种元素按电负性从小到大的排列是
Mg、Al、P、S、O、F
Mg、Al、P、S、O、F
.(4)C、D、E、F元素形成的最高价氧化物分别是
MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物
MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物
(填“离子”“共价”)化合物.(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:
H2SO4、H3PO4、Al(OH)3、Mg(OH)2
H2SO4、H3PO4、Al(OH)3、Mg(OH)2
.【选修3--物质结构与性质】
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%.推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.请回答下列问题:
(1)写出As基态原子的价电子排布式: .
(2)As的第一电离能比Ga的 (填“大”或“小”,下同),As的电负性比Ga的 .
(3)比较As的简单氢化物与同族第二、三周期元素所形成的简单氢化物的沸点,并说明理由: .
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与 个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为 .在四大晶体类型中,GaAs属于 晶体.
(5)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,此反应的化学方程式为 ;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化轨道类型为 .
查看习题详情和答案>>
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%.推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.请回答下列问题:
(1)写出As基态原子的价电子排布式:
(2)As的第一电离能比Ga的
(3)比较As的简单氢化物与同族第二、三周期元素所形成的简单氢化物的沸点,并说明理由:
(4)GaAs的晶体结构与单晶硅相似,在GaAs晶体中,每个Ga原子与
(5)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,此反应的化学方程式为