摘要:⑴2NH3 + 3CuO 3Cu + N2 + 3H2O . ⑵利用NaOH的碱性和遇水放热的性质.使NH3·H2O 分解后逸出 . ⑶ C , ⑷黑色固体变成了亮红色 . ⑸吸收多余的NH3 , ⑹3a/22.4mol,9a/11.2b . ⑺减少 .因为由NH3带出的水蒸气进入D装置.导致H原子的个数增加.
网址:http://m.1010jiajiao.com/timu3_id_380763[举报]
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.I已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
CO(g)+
| 1 |
| 2 |
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
则C的燃烧热
II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+C02(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1)
C.2H20(l)=2H2(g)+02(g)
D.2C0(g)+02(g)=2C02(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
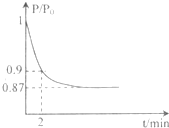
(2)某实验小组模拟工业合成氨反应N2+3H2
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为
③若提高N2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
| O | 2- 3 |
(2013?红桥区一模)已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).

请回答:
(1)单质B的组成元素在周期表中的位置是
(2)戊的化学式为
(3)NaClO的电子式为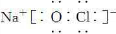
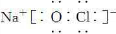 .
.
(4)甲与水反应的化学方程式为
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:
查看习题详情和答案>>

请回答:
(1)单质B的组成元素在周期表中的位置是
第2周期第ⅤA族
第2周期第ⅤA族
.(2)戊的化学式为
Al(OH)3
Al(OH)3
.戊与强碱反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(3)NaClO的电子式为
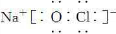
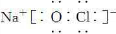
(4)甲与水反应的化学方程式为
AlN+3H2O=Al(OH)3↓+NH3↑
AlN+3H2O=Al(OH)3↓+NH3↑
.(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:
2NH3+NaClO═N2H4+NaCl+H2O
2NH3+NaClO═N2H4+NaCl+H2O
.(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
.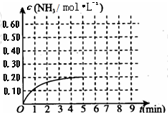 (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=0.02mol?L-1?min-1
0.02mol?L-1?min-1
.(2)该反应的化学平衡常数表达式为
| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
(填序号)a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡
向右
向右
移动(填“向右”、“向左”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”).(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
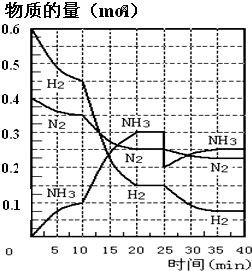 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ?mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ?mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:(1)10min内以NH3表示的平均反应速率
0.005mol/(L.min)
0.005mol/(L.min)
;(2)在10~20min内:NH3浓度变化的原因可能是
A
A
;A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:
20-25min
20-25min
平衡常数K1=| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
45.5%
45.5%
;(4)在反应进行至25min时,曲线发生变化的原因:
分离出0.1molNH3
分离出0.1molNH3
.