网址:http://m.1010jiajiao.com/timu3_id_38063[举报]
| ||
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量.
(SO2沸点为-10.02℃)请回答相关问题:

(1)A瓶所盛试剂的作用是
(2)A瓶要用冷水冷却的原因是
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则
A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
理由是
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)
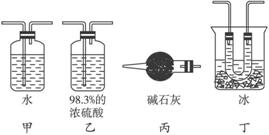
图5-6
(1)请你从图5-6所示的装置中选择能使SO2与SO3分离的装置,将其编号及其作用原理填入表中。
选用装置(标号) | 简答实验原理 |
|
|
|
|
(2)试评价你所选择的每一件装置的不足之处,择其一条予以说明,并提出简单可行的改进措施。
查看习题详情和答案>>(Fe2O3),反应原理是:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)
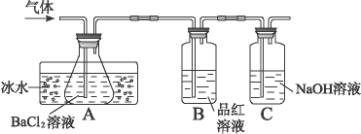
请回答相关问题:
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是_______________,发生反应的离子方程式为_________________________________________________________。
(2)B瓶所盛试剂的作用是______________________________________;C瓶所盛试剂的作用是___________________________________________________________。
(3)A瓶要用冷水冷却的原因是______________________________________________。
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理______(填“合理”“不合理”),理由是______________________________________。
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:_______________________________________________________________。
查看习题详情和答案>>2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)
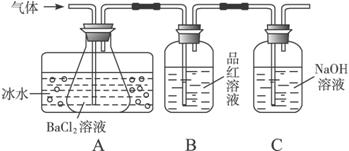
请完成相关问题:
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是____________,发生反应的离子方程式为__________________。
(2)B瓶所盛的试剂的作用是__________________________________;C瓶所盛试剂的作用是____________________________________________。
(3)A瓶要用冷水冷却的原因是______________________________________。
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理________(填“合理”“不合理”),理由是________________________________。
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:________
________________________________。
查看习题详情和答案>>![]()
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)?

请回答相关问题:?
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是________,发生反应的离子方程式为________________________。
(2)B瓶所盛的试剂的作用是________________;C瓶?所盛试剂的作用是________________。
(3)A瓶要用冷水冷却的原因是________________________。?
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理________(填“合理”“不合理”),理由是________________________。?
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:________。
查看习题详情和答案>>