题目内容
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:2FeSO4
Fe2O3+SO2↑+SO3↑.
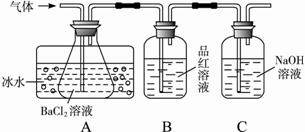
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量.
(SO2沸点为-10.02℃)请回答相关问题:
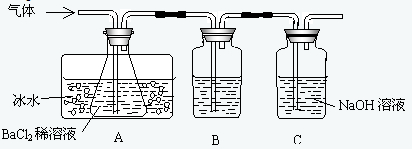
(1)A瓶所盛试剂的作用是
(2)A瓶要用冷水冷却的原因是
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则
A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
理由是
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)
| ||
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量.
(SO2沸点为-10.02℃)请回答相关问题:

(1)A瓶所盛试剂的作用是
检验并吸收SO3
检验并吸收SO3
;B瓶所盛的试剂是品红试液
品红试液
;C瓶所盛试剂的作用是吸收SO2
吸收SO2
;(2)A瓶要用冷水冷却的原因是
SO3与H2O反应放出大量的热
SO3与H2O反应放出大量的热
;(3)将此反应生成的气体通入A瓶BaCl2溶液中,则
B、D
B、D
;(填编号)A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
理由是
SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀
SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀
;(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)
A瓶中滴入BaCl2溶液,直至不再产生新的沉淀
A瓶中滴入BaCl2溶液,直至不再产生新的沉淀
.分析:(1)检验生成气体,应将SO2和SO3两种气体分离,并检验SO3气体,用品红检验SO2气体,SO2有毒,不能排放到空气中,应进行尾气吸收;
(2)SO3与H2O反应是放热反应,如不冷却,通入品红中的气体中含有SO3气体;
(3)将气体通入BaCl2溶液发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,并生成硫酸钡沉淀;
(4)测定已分解的FeSO4的质量,应使SO3气体完全反应;
(2)SO3与H2O反应是放热反应,如不冷却,通入品红中的气体中含有SO3气体;
(3)将气体通入BaCl2溶液发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,并生成硫酸钡沉淀;
(4)测定已分解的FeSO4的质量,应使SO3气体完全反应;
解答:解:(1)SO3气体溶于水,发生反应SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4+2HCl,SO2气体具有漂白性,可使品红溶液褪色,并且SO2有毒,不能排放到空气中,根据SO2气体具有酸性,可用碱液吸收,
故答案为:检验并吸收SO3;品红试液;吸收SO2;
(2)SO3与H2O反应是放热反应,如不冷却,通入品红中的气体中含有SO3气体,故答案为:SO3与H2O反应放出大量的热;
(3)SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀,将此反应生成的气体通入A瓶BaCl2溶液中,会有BaSO4沉淀生成,并析出SO2气体,
故答案为:B、D; SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀;
(4)测定已分解的FeSO4的质量,应使SO3气体完全生成BaSO3沉淀,否则会有较大误差,故答案为:A瓶中滴入BaCl2溶液,直至不再产生新的沉淀.
故答案为:检验并吸收SO3;品红试液;吸收SO2;
(2)SO3与H2O反应是放热反应,如不冷却,通入品红中的气体中含有SO3气体,故答案为:SO3与H2O反应放出大量的热;
(3)SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀,将此反应生成的气体通入A瓶BaCl2溶液中,会有BaSO4沉淀生成,并析出SO2气体,
故答案为:B、D; SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀;
(4)测定已分解的FeSO4的质量,应使SO3气体完全生成BaSO3沉淀,否则会有较大误差,故答案为:A瓶中滴入BaCl2溶液,直至不再产生新的沉淀.
点评:本题考查物质的分离和检验,做题时要抓住题给信息,充分把握物质的性质,这是解答元素化合物知识的关键之处,本题有一定难度.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)X溶液、(Ⅲ)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
| A.(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| B.可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C.(Ⅱ)所盛X可为品红溶液 |
| D.(Ⅲ)的作用是吸收有毒的SO2气体 |