摘要:11.(06年高密市三月份教学质量检测.23)某反应体系中有反应物和生成物共六种:H2C2O4.CO2.(VO2)2SO4.VOSO4.H2SO4.H2O.其中(VO2)2SO4是反应物之一. (1)完成并配平该反应的化学方程式: . (2)反应中的氧化剂是 .当有1mol H2C2O4参加反应时.转移电子 mol. (3)(VO2)2SO4与NaOH发生复分解反应的产物之一是Na3VO4.写出这一反应的化学 方程式: .
网址:http://m.1010jiajiao.com/timu3_id_37935[举报]
XeO3是一种不稳定的物质,具有强氧化性.在某一反应体系中有反应物和生成物的微粒共6种,即Mn2+、MnO4-、Xe、XeO3、H+、H2O
(1)发生氧化反应的微粒是
(2)反应现象为:①有气泡产生,②
(3)该反应的离子方程式为:
(4)将适量的XeO3投入30mL 0.1mol/L Mn2+的水溶液中,刚好完全反应.此时转移电子
查看习题详情和答案>>
(1)发生氧化反应的微粒是
Mn2+
Mn2+
.(2)反应现象为:①有气泡产生,②
溶液显紫红色
溶液显紫红色
.(3)该反应的离子方程式为:
5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+
5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+
.(4)将适量的XeO3投入30mL 0.1mol/L Mn2+的水溶液中,刚好完全反应.此时转移电子
0.015
0.015
mol.将反应后的溶液稀释至90mL,所得溶液的pH=1
1
.某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失.
(1)该反应的氧化剂是
(2)在该反应中,发生氧化反应的过程是
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
 .
.
(4)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为
查看习题详情和答案>>
(1)该反应的氧化剂是
Fe2(SO4)3
Fe2(SO4)3
.(2)在该反应中,发生氧化反应的过程是
SnC12
SnC12
→SnC14
SnC14
.(3)写出该反应的化学方程式,并标出电子转移的方向和数目:


(4)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为
1:2
1:2
.完成下面各题
(1)NaCl的摩尔质量是
(2)某一反应体系中有反应物和生成物共5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3.请将各物质填入下面对应的横线上,组成一个配平的化学方程式.
(3)氯元素是重要的“成盐元素”,工业上将氯气通入石灰乳中制取漂白粉,漂白粉的有效成分是
(4)浓硫酸在实验室可用来干燥N2、HCl等气体,这是利用了浓硫酸的
查看习题详情和答案>>
(1)NaCl的摩尔质量是
58.5g/mol
58.5g/mol
;0.1molCO2的质量是4.4
4.4
g,它在标准状况是的体积约为2.24
2.24
L;在0.5L 0.2mol/L的 Ba(NO3)2溶液中NO3-的物质的量浓度为0.4mol/L
0.4mol/L
.(2)某一反应体系中有反应物和生成物共5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3.请将各物质填入下面对应的横线上,组成一个配平的化学方程式.
30HNO3
30HNO3
+24FeSO4
24FeSO4
→8Fe(NO3)3
8Fe(NO3)3
+8Fe2(SO4)3
8Fe2(SO4)3
+3N2O
3N2O
+15
15
H2O(3)氯元素是重要的“成盐元素”,工业上将氯气通入石灰乳中制取漂白粉,漂白粉的有效成分是
Ca(ClO)2
Ca(ClO)2
;漂白粉在空气中放置易失效,原因是Ca(ClO)2+CO2+H2O=CaCO3+2HClO,HClO易分解
Ca(ClO)2+CO2+H2O=CaCO3+2HClO,HClO易分解
;在实验室中常用苛性钠溶液吸收多余的氯气,防止空气污染,写出反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)浓硫酸在实验室可用来干燥N2、HCl等气体,这是利用了浓硫酸的
吸水
吸水
性; 蔗糖遇浓硫酸变黑,是由于浓硫酸具有脱水
脱水
性;常温下,可用铁质容器盛装浓硫酸的原因是常温下浓硫酸能使铁铝发生钝化
常温下浓硫酸能使铁铝发生钝化
.某一反应体系中有反应物和生成物共7种粒子:CuS、SO2、H+、Mn2+、Cu2+、MnO4-、H2O,已知H2O是反应产物之一.
(1)请将除H2O外的6种粒子分别填在下列对应的横线上,组成一个离子方程式,并配平该反应方程式.
(2)当该反应生成0.3mol还原产物时,氧化剂得到
查看习题详情和答案>>
(1)请将除H2O外的6种粒子分别填在下列对应的横线上,组成一个离子方程式,并配平该反应方程式.
6MnO4-
6MnO4-
+5CuS
5CuS
+28H+
28H+
=5Cu2+
5Cu2+
+5SO2↑
5SO2↑
+6Mn2+
6Mn2+
+14
14
H2O(2)当该反应生成0.3mol还原产物时,氧化剂得到
1.5
1.5
mol电子;生成的气态产物在标况下的体积为5.6
5.6
L.(2013?烟台模拟)硫、氮、碘都是重要的非金属元素.
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=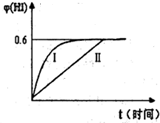
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
查看习题详情和答案>>
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
H2S
H2S
.若反应过程中转移了0.3mol电子,则反应的HNO3的质量是6.3
6.3
g.(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=
-9
-9
kJ?mol-1.
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
0.05
0.05
mol?L-1.②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
AB
AB
(填编号),在这种条件下平衡常数K值不变
不变
(填“增大”、“变小”或“不变’,).A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
37%
37%
.