题目内容
(1)NaCl的摩尔质量是
(2)某一反应体系中有反应物和生成物共5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3.请将各物质填入下面对应的横线上,组成一个配平的化学方程式.
(3)氯元素是重要的“成盐元素”,工业上将氯气通入石灰乳中制取漂白粉,漂白粉的有效成分是
(4)浓硫酸在实验室可用来干燥N2、HCl等气体,这是利用了浓硫酸的
(2)元素处于最高价只有氧化性,元素居于低价有还原性,根据所给物质的化合价情况来分析配平;
(3)漂白粉的有效成分是次氯酸钙,在空气中次氯酸钙与水、二氧化碳反应生成次氯酸,次氯酸分解,漂白粉失效;
氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(4)浓硫酸具有吸水性,可以干燥气体;浓硫酸具有脱水性,是蔗糖碳化;常温下浓硫酸能使铁铝发生钝化,可以用铁质容器盛装浓硫酸.
故答案为:58.5g/mol;4.4g;2.24L;0.4mol/L;
(2)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:30HNO3、24FeSO4=8Fe(NO3)3、8Fe2(SO4)3、3N2O、15;
(3)漂白粉的有效成分是次氯酸钙,在空气中次氯酸钙发生反应Ca(ClO)2+CO2+H2O=CaCO3+2HClO,次氯酸分解,漂白粉失效;
氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3+2HClO,HClO易分解;Cl2+2OH-=Cl-+ClO-+H2O;
(4)浓硫酸具有吸水性,可以干燥气体;浓硫酸具有脱水性,是蔗糖碳化;常温下浓硫酸能使铁铝发生钝化,可以用铁质容器盛装浓硫酸,
故答案为:吸水性;脱水性;常温下浓硫酸能使铁铝发生钝化.

 阅读快车系列答案
阅读快车系列答案针对下面10种元素,完成以下各小题。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
| C | N | O |
| Ne |
| 3 | Na | Mg | Al | Si |
| S | Cl | m] |
(1)地壳中含量最多的元素是 (填名称)。
(2)化学性质最不活泼的元素是 (填元素符号)。
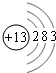
(3)Al的原子结构示意图为 。
(4)C与N相比,原子半径较小的是 。
(5)最高价氧化物对应的水化物碱性最强的是 (填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是 。
(7)S和Cl相比,元素非金属性较强的是 。
(8)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式 。
针对下面10种元素,完成以下各小题。
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
C |
N |
O |
|
Ne |
|
3 |
Na |
Mg |
Al |
Si |
|
S |
Cl |
m] |
(1)地壳中含量最多的元素是 (填名称)。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)Al的原子结构示意图为 。
(4)C与N相比,原子半径较小的是 。
(5)最高价氧化物对应的水化物碱性最强的是 (填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是 。
(7)S和Cl相比,元素非金属性较强的是 。
(8)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式 。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)化学性质最不活泼的元素是______(填元素符号).
(3)Al的原子结构示意图为______.
(4)C与N相比,原子半径较小的是______.
(5)最高价氧化物对应的水化物碱性最强的是______(填化学式).
(6)MgO和Al2O3中,属于两性氧化物的是______.
(7)S和Cl相比,元素非金属性较强的是______.
(8)可用来制造光导纤维的物质是______,晶体硅的主要用途是______(写出一种).