��Ŀ����
��2013?��̨ģ�⣩�����ⶼ����Ҫ�ķǽ���Ԫ�أ�
��1��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�S��H2S��HNO3��NO��H2O���÷�Ӧ�л�ԭ����
��2����֪��2I��g���TI2��g����H=-151 kJ?mol-1��2H��g���TH2��g����H=-436 kJ?mol-1��HI��g��=H��g��+I��g����H=+298 kJ?mol-1����ͬ�����£�H2��I2��Ӧ����HI���Ȼ�ѧ����ʽΪ��H2��g��+I2��g��=2HI��g����H=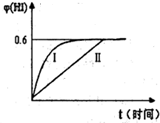
��3����1molI2��g����2molH2��g������ij2L�ܱ������У���һ���¶��·�����Ӧ��H2��g��+I2��g��?2HI��g������ƽ�⣮HI����������գ�HI����ʱ��仯��ͼ����II��ʾ��
�ٴﵽƽ��ʱ��I2��g�������ʵ���Ũ��Ϊ
�ڱ��ּ���ķ�Ӧ������ʵ������䣬���ı䷴Ӧ��
������ijһ�����¦գ�HI���ı仯������I��ʾ���������������
A�����������£���С��Ӧ���ݻ� B�����������£������ʵ�����
C���ں����£������¶� D���ں����£�����N2ʹ����ѹǿ����
���������¶Ȳ��䣬����һ��ͬ��2L�ܱ������м���1mol H2��g����2mol Hl��g����������Ӧ�ﵽƽ��ʱ��H2���������Ϊ
��1��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�S��H2S��HNO3��NO��H2O���÷�Ӧ�л�ԭ����
H2S
H2S
������Ӧ������ת����0.3mol���ӣ���Ӧ��HNO3��������6.3
6.3
g����2����֪��2I��g���TI2��g����H=-151 kJ?mol-1��2H��g���TH2��g����H=-436 kJ?mol-1��HI��g��=H��g��+I��g����H=+298 kJ?mol-1����ͬ�����£�H2��I2��Ӧ����HI���Ȼ�ѧ����ʽΪ��H2��g��+I2��g��=2HI��g����H=
-9
-9
kJ?mol-1��
��3����1molI2��g����2molH2��g������ij2L�ܱ������У���һ���¶��·�����Ӧ��H2��g��+I2��g��?2HI��g������ƽ�⣮HI����������գ�HI����ʱ��仯��ͼ����II��ʾ��
�ٴﵽƽ��ʱ��I2��g�������ʵ���Ũ��Ϊ
0.05
0.05
mol?L-1���ڱ��ּ���ķ�Ӧ������ʵ������䣬���ı䷴Ӧ��
������ijһ�����¦գ�HI���ı仯������I��ʾ���������������
AB
AB
�����ţ���������������ƽ�ⳣ��Kֵ����
����
�����������С�����䡯������A�����������£���С��Ӧ���ݻ� B�����������£������ʵ�����
C���ں����£������¶� D���ں����£�����N2ʹ����ѹǿ����
���������¶Ȳ��䣬����һ��ͬ��2L�ܱ������м���1mol H2��g����2mol Hl��g����������Ӧ�ﵽƽ��ʱ��H2���������Ϊ
37%
37%
����������1���������ʵ������ԡ���ԭ��ǿ��ȷ����ԭ�������������ת�Ƶ���֮��Ĺ�ϵ���㣻
��2�����ݸ�˹���ɽ��м��㣻
��3���ٸ��ݵ⻯��������������ƽ��ʱ�⻯������ʵ������ٸ��ݵ⻯��͵�֮��Ĺ�ϵʽ����ʣ��ĵ⣬c��I2��=
��
�ڷ�Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ�⣬ѹǿ�ʹ����Ը÷�Ӧƽ����Ӱ�죻
�����õ�Чƽ���ж����������������
��2�����ݸ�˹���ɽ��м��㣻
��3���ٸ��ݵ⻯��������������ƽ��ʱ�⻯������ʵ������ٸ��ݵ⻯��͵�֮��Ĺ�ϵʽ����ʣ��ĵ⣬c��I2��=
| n(I2)(ʣ��) |
| V |
�ڷ�Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ�⣬ѹǿ�ʹ����Ը÷�Ӧƽ����Ӱ�죻
�����õ�Чƽ���ж����������������
����⣺��1������������Դ����������ڸ÷�Ӧ�����������������ڷ�Ӧ�еõ��ӻ��ϼ۽��ͣ��������ڷ�Ӧ��ʧ��������ԭ�����÷�Ӧ����ʽΪ��3H2S+2HNO3=3S+2NO+4H2O����126g����μӷ�Ӧʱת�Ƶ��ӵ����ʵ�����6mol��������Ӧ������ת����0.3mol���ӣ���Ӧ��HNO3��������
=6.3g���ʴ�Ϊ��H2S��6.3��
��2��I2��g��=2I��g����H=+151 kJ?mol-1�٣�
H2��g��=2H��g����H=+436 kJ?mol-1��
H��g��+I��g��=HI��g����H=-298 kJ?mol-1 �ۣ�
������ʽ��+��+�ۡ�2��H2��g��+I2��g��=2HI��g����H�T��+151 kJ?mol-1��+��+436 kJ?mol-1��+2����-298 kJ?mol-1 ��
=-9kJ/mol���ʴ�Ϊ��-9��
��3���ٸ÷�Ӧ��һ����Ӧǰ�������������Ļ�ѧ��Ӧ�����Է�Ӧ������������ʵ�����3mol��ͬһ�����и����������������������ʵ�������������ƽ��ʱ�⻯������ʵ���=3mol��0.6=1.8mol����μӷ�Ӧ��n��I2��=
��1.8mol=0.9mol��ʣ���n��I2��=1mol-0.9mol=0.1mol������ƽ��ʱc��I2��=
=0.05mol/L��
�ʴ�Ϊ��0.05��
�ڷ�Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ�⣬����ѹǿ�ͼ�������Ը÷�Ӧƽ����Ӱ�죬��������Ӧ���ʣ����̷�Ӧʱ�䣬�¶Ȳ���ƽ�ⳣ�����䣬�ʴ�Ϊ��AB�����䣻
�������������䣬��2L�ܱ������м���1mol H2��g����2mol Hl��g�����൱����2L�ܱ������м���1molI2��g����2molH2��g�������Ժ͵�һ���ǵ�Чƽ�⣬�����ʵ�����������䣬ʣ�����������ʵ���=2mol-0.9mol=1.1mol�����������������=
��100%=37%��
�ʴ�Ϊ��37%��
| 126g��0.3mol |
| 6mol |
��2��I2��g��=2I��g����H=+151 kJ?mol-1�٣�
H2��g��=2H��g����H=+436 kJ?mol-1��
H��g��+I��g��=HI��g����H=-298 kJ?mol-1 �ۣ�
������ʽ��+��+�ۡ�2��H2��g��+I2��g��=2HI��g����H�T��+151 kJ?mol-1��+��+436 kJ?mol-1��+2����-298 kJ?mol-1 ��
=-9kJ/mol���ʴ�Ϊ��-9��
��3���ٸ÷�Ӧ��һ����Ӧǰ�������������Ļ�ѧ��Ӧ�����Է�Ӧ������������ʵ�����3mol��ͬһ�����и����������������������ʵ�������������ƽ��ʱ�⻯������ʵ���=3mol��0.6=1.8mol����μӷ�Ӧ��n��I2��=
| 1 |
| 2 |
| 0.1mol |
| 2L |
�ʴ�Ϊ��0.05��
�ڷ�Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ�⣬����ѹǿ�ͼ�������Ը÷�Ӧƽ����Ӱ�죬��������Ӧ���ʣ����̷�Ӧʱ�䣬�¶Ȳ���ƽ�ⳣ�����䣬�ʴ�Ϊ��AB�����䣻
�������������䣬��2L�ܱ������м���1mol H2��g����2mol Hl��g�����൱����2L�ܱ������м���1molI2��g����2molH2��g�������Ժ͵�һ���ǵ�Чƽ�⣬�����ʵ�����������䣬ʣ�����������ʵ���=2mol-0.9mol=1.1mol�����������������=
| 1.1mol |
| 3mol |
�ʴ�Ϊ��37%��
���������⿼�鷴Ӧ�ȵļ��㡢������ԭ��Ӧ����������Ի�ѧƽ���Ӱ���֪ʶ�㣬ע���������ķ�Ӧ�ص㼰��Чƽ���Ӧ�ã�Ϊ�״��㣮

��ϰ��ϵ�д�
 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
�����Ŀ