网址:http://m.1010jiajiao.com/timu3_id_378786[举报]
 ”或“
”或“ ”表示)、烧杯、灵敏电流计(用“
”表示)、烧杯、灵敏电流计(用“ ”表示)和两个电极棒(分别是M、N) 进行电化学实验探究。
”表示)和两个电极棒(分别是M、N) 进行电化学实验探究。 甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。 请根据上述同学的实验现象回答以下问题:
(1)M电极棒材料是(写化学式)___________,N电极棒材料是(写化学式)____________。
(2)在下列虚框内完成对应三个同学的装置图:


(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式) __________。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是__________,发生反应的离子方程式是____________ ,他还可选用的检验试剂是____________。
某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装 置及胶塞等略。
置及胶塞等略。
![]() 实验步骤如下:
实验步骤如下:
![]() I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
![]() II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
![]() III. 当不再有水生成,停止加热。
III. 当不再有水生成,停止加热。
![]() IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
![]() V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
![]() 根据以上操作过程回答以下问题:
根据以上操作过程回答以下问题:
![]() (1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
(1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
![]() (2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
(2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
![]() (3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
(3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
①洗去反应剩余的苯甲酸 ②洗去反应混合液中的乙醇
③降低苯甲酸乙酯的溶解度,有利于析出、分层,便于下一步的分液
④有利于苯甲酸乙酯的水解
(4)写出该反应的化学方程式
(5)实验过程中,如果温度过高会发生副反应,产生一种能使溴的四氯化碳溶液褪色的
无色稍有气味的气体,该气体的结构简式为
(6)实验结束收集分水器分离出的水,并测得质量为1.44g,计算苯甲酸乙酯的产率为 。实验中苯甲酸乙酯的实际产率总是小于此计算值,其原因可能是
①加热过程中乙醇挥发,冷凝后滴入分水器中,随冷凝的水一起被分出
②实验过程中,发生了副反应
③苯甲酸乙酯洗涤、蒸发过程中有损失。
查看习题详情和答案>>

(1)小组查阅资料得出:乙炔能与硫酸酸化的KMnO4反应生成Mn2+和CO2,该反应的化学方程式是
(2)在装置A中使用饱和食盐水而不直接滴加水的原因
(3)B中的CuSO4溶液用于除去乙炔中混有的H2S、PH3、AsH3等气体,CuSO4溶液除H2S气体的反应类型是
(4)实验前D中含有x mol KMnO4的酸性溶液,实验时向D中通入一定量的乙炔直至KMnO4酸性溶液恰好完全褪色,实验完毕后装置D及E的总质量共增重y g,通过计算求出所测乙炔的相对分子质量(用含字母x、y的代数式表示):
| x |
| y |
| x |
| y |
(5)若该小组的实验原理及所有操作都正确,下列因素中,对所测乙炔相对分子质量的值不会产生影响的是
A.将装置A中产生的混合气体直接通入D中的KMnO4酸性溶液
B.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
C.通入过量纯净的乙炔气体于KMnO4酸性溶液时,有部分乙炔未被氧化而逸出
(6)另一活动小组的同学认为上述实验装置仍存在不足,则改进的措施是
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,1g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式:
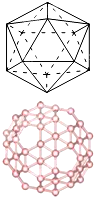
(2)自发现富勒烯C60以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究.C60分子是形如球状的多面体,该结构的建立基于以下考虑:削去右图多面体(含12个顶点,20个正三角形)的每一个顶角,得到由一定数目的正五边形和正六边形所组成的多面体,即为C60分子,该多面体中含有90条棱,且每个碳原子都达到了8电子的稳定结构.已知几种共价键的键能数据如下表:
利用下表数据估算得C60分子的燃烧热为
| 化学键 | C-C | C=C | C≡C | C=O | O=O |
| 键能/(kJ?mol-1) | a | b | c | d | e |
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值.
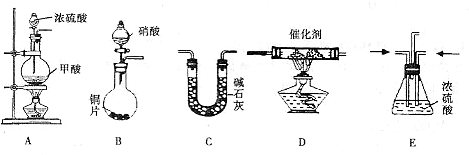
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
| ||
| △ |
试回答下列问题:
(1)仪器的连接顺序为
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体(2)E装置的作用是
(3)写出D中的NOX与CO反应的化学方程式
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目
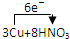 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4).则收集到的气体中NO的物质的量为
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由: