题目内容
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,1g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1
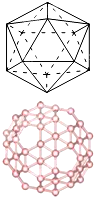
(2)自发现富勒烯C60以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究.C60分子是形如球状的多面体,该结构的建立基于以下考虑:削去右图多面体(含12个顶点,20个正三角形)的每一个顶角,得到由一定数目的正五边形和正六边形所组成的多面体,即为C60分子,该多面体中含有90条棱,且每个碳原子都达到了8电子的稳定结构.已知几种共价键的键能数据如下表:
利用下表数据估算得C60分子的燃烧热为
(120d-60a-30b-60e) kJ?mol-1
(120d-60a-30b-60e) kJ?mol-1
.| 化学键 | C-C | C=C | C≡C | C=O | O=O |
| 键能/(kJ?mol-1) | a | b | c | d | e |
80
80
.分析:(1)依据化学方程式的配平系数计算对应量下的反应热,注意标注物质聚集状态;
(2)首先可从2个方面可判断C60分子含有碳碳双键,一是从名称上分析,“富勒烯“中的“烯“字说明分子中含有碳碳双键,二是从结构上分析,由于C60分子中每个碳原子都达到了8电子的稳定结构,因此每个碳原子的连接方式必为,故分子中含有碳碳双键.同理分析得C60分子中无碳碳叁键.
(3)本题中只要求出C60分子中含有的六边形数目即可得到答案.由(1)中信息可知,当削去一个顶角后即得到一个正五边形,现由12个顶点,故得到正五边形数为12,原多面体的面即为削去顶角后所得到的正六边形数,故正六边形数目为20,所以n等于20+60=80;
(2)首先可从2个方面可判断C60分子含有碳碳双键,一是从名称上分析,“富勒烯“中的“烯“字说明分子中含有碳碳双键,二是从结构上分析,由于C60分子中每个碳原子都达到了8电子的稳定结构,因此每个碳原子的连接方式必为,故分子中含有碳碳双键.同理分析得C60分子中无碳碳叁键.
(3)本题中只要求出C60分子中含有的六边形数目即可得到答案.由(1)中信息可知,当削去一个顶角后即得到一个正五边形,现由12个顶点,故得到正五边形数为12,原多面体的面即为削去顶角后所得到的正六边形数,故正六边形数目为20,所以n等于20+60=80;
解答:解:(1)1g甲醇燃烧生成CO2和液态水时放热22.7kJ,所以64g甲醇燃烧生成CO2和液态水时放热1452.8kJ,依据热化学方程式的书写方法写出,注意标注物质的聚集状态和反应的反应热,所以反应的热化学方程式为:2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1;
故答案为:2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1 ;
(2)首先可从2个方面可判断C60分子含有碳碳双键,一是从名称上分析,“富勒烯“中的“烯“字说明分子中含有碳碳双键,二是从结构上分析,由于C60分子中每个碳原子都达到了8电子的稳定结构,因此每个碳原子的连接方式必为,故分子中含有碳碳双键.同理分析得C60分子中无碳碳叁键.表示C60分子的燃烧热的热化学方程式为C60(s)+60O2(g)=60CO2(g),因此欲用键能来计算该反应的反应热时,必须先求出C60分子中含有的碳碳双键和碳碳单键数.由C60分子的结构特点可知,n(单键)+n(双键)=90(棱边数),根据碳原子的连接方式可得n(双键)=60/2=30,则n(单键)=60,该反应的△H=反应物的键能之和-生成物的键能之和=-(120d-60a-30b-60e) kJ?mol-1,故其燃烧热为(120d-60a-30b-60e) kJ?mol-1;故答案为:(120d-60a-30b-60e) kJ?mol-1;
(3)本题中只要求出C60分子中含有的六边形数目即可得到答案.由(1)中信息可知,当削去一个顶角后即得到一个正五边形,现由12个顶点,故得到正五边形数为12,原多面体的面即为削去顶角后所得到的正六边形数,故正六边形数目为20,所以n等于20+60=80;
故答案为:80;
| ||
. |
故答案为:2CH3OH(l)+3O2(g)
| ||
. |
(2)首先可从2个方面可判断C60分子含有碳碳双键,一是从名称上分析,“富勒烯“中的“烯“字说明分子中含有碳碳双键,二是从结构上分析,由于C60分子中每个碳原子都达到了8电子的稳定结构,因此每个碳原子的连接方式必为,故分子中含有碳碳双键.同理分析得C60分子中无碳碳叁键.表示C60分子的燃烧热的热化学方程式为C60(s)+60O2(g)=60CO2(g),因此欲用键能来计算该反应的反应热时,必须先求出C60分子中含有的碳碳双键和碳碳单键数.由C60分子的结构特点可知,n(单键)+n(双键)=90(棱边数),根据碳原子的连接方式可得n(双键)=60/2=30,则n(单键)=60,该反应的△H=反应物的键能之和-生成物的键能之和=-(120d-60a-30b-60e) kJ?mol-1,故其燃烧热为(120d-60a-30b-60e) kJ?mol-1;故答案为:(120d-60a-30b-60e) kJ?mol-1;
(3)本题中只要求出C60分子中含有的六边形数目即可得到答案.由(1)中信息可知,当削去一个顶角后即得到一个正五边形,现由12个顶点,故得到正五边形数为12,原多面体的面即为削去顶角后所得到的正六边形数,故正六边形数目为20,所以n等于20+60=80;
故答案为:80;
点评:本题考查了热化学方程式的书写方法应用,晶体结构的分析判断和计算应用,燃烧热的概念分析,燃烧热和化学键键能的计算关系,关键是富勒烯的结构分析和题干信息的应用,题目难度中等.

练习册系列答案
相关题目